
| A、Na→Na2O2 |
| B、Si→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |


科目:高中化学 来源: 题型:
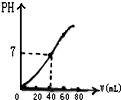 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点对应的沉淀只有BaSO4 |
| B、c点溶液铝元素以AlO2- 的形式存在 |
| C、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag2O+H2O2═Ag+O2↑+H2O |
| B、H2O2═H2O+O2↑ |
| C、H2O2+Cr2(SO4)3+KOH═K2CrO4+K2SO4+H2O |
| D、Na2O2+HCl═H2O2+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液变为红色 |
| B、可以听到“嘶嘶”的响声 |
| C、钠熔化成闪亮的小球 |
| D、钠在水面上四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4?14H2O | ||
| B、CH4?8H2O | ||
C、CH4?7
| ||
| D、CH4?6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com