
分析 (1)Cu元素是29号元素,原子核外电子数为29,失去一个电子形成Cu+,根据核外电子排布规律书写;
(2)N元素原子的核外电子排布式为1s22s22p3,L层中s能级的电子为成对电子;NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构;等电子体是指具有相同电子数目和原子数目的分子或离子;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(4)[Cu(NH3)4]SO4•H2O中离子是[Cu(NH3)4]2+,铜离子含有空轨道,氨气有孤电子对,二者形成配位键,氨气中存在共价键;
(5)根据相似相溶原理和二氧化硫的性质分析.
解答 解:(1)Cu元素是29号元素,原子核外电子数为29,失去一个电子形成Cu+,则Cu+的核外电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)N元素原子的核外电子排布式为1s22s22p3,L层中s能级的电子为成对电子;
NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构;CH4中电子数为:6+4=10,原子数为5,则CH4和NH4+是等电子体;
故答案为:1;正四面体;CH4;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、
O-H…O、N-H…N,
故答案为:O-H…N、N-H…O;
(4)[Cu(NH3)4]SO4•H2O中离子是[Cu(NH3)4]2+,铜离子含有空轨道,氨气有孤电子对,二者形成配位键,氨气中存在共价键,所以该离子中存在的化学键有配位键和共价键;
故答案为:[Cu(NH3)4]2+;共价键、配位键;
(5)S元素的一种常见低价氧化物为二氧化硫,二氧化硫是极性分子,水是极性溶剂,极性分子易溶于极性溶剂,而且二氧化硫与水反应生成亚硫酸,所以二氧化硫易溶于水;
故答案为:SO2是极性分子易溶于极性溶剂中,而且SO2与水反应生成亚硫酸.
点评 本题主要考查电子排布式、杂化理论的应用、等电子体、氢键、化学键等,题目难度中等,注意把握氢键的表示以及杂化类型的判断方法,注意基础知识的全面掌握.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 三种物质质子数之比为1:2:3 | B. | 三种物质中子数之比为1:1:1 | ||
| C. | 三种物质的摩尔质量之比为8:9:10 | D. | 三种物质的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙炔在氧气中燃烧;乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 工业上由乙烯和水反应生成乙醇;由苯与液溴反应生成溴苯 | |
| D. | 由乙烯制取聚乙烯;由苯制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和液溴光照取代产物为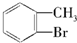 | |
| B. | 乙苯和氯气光照生成产物有11种 | |
| C. | 邻二甲苯和液溴在光照下取代产物可能为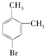 | |
| D. | 甲苯和氯气在光照条件下生成一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成 | |
| B. | 氨气极易溶解于水,因此可用来做喷泉实验 | |
| C. | 氯化铵受热分解有氨气生成,因此实验室可以用加热氯化铵的方法制备氨气 | |
| D. | 氨具有还原性,可以被氧化成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
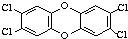 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )| A. | 此分子中共平面的原子最多有18个 | B. | 它难溶于水 | ||
| C. | 它的一溴取代物只有一种 | D. | 它能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com