
分析 (1)根据化学方程式Fe+H2SO4=FeSO4+H2↑中气体与锌的关系计算;
(2)根据氢气与电子的关系式计算;
(3)根据氢气与硫酸的关系计算硫酸的物质的量,再根据物质的量浓度公式计算其浓度.
解答 解:(1)铁作负极,设铁片的质量减少了x,
Fe+H2SO4=FeSO4+H2↑~2mole-
56g 2mol
x 0.3mol
所以 x=8.4g,
答:消耗的金属是铁,消耗的质量8.4g;
(2)铜片为正极,设铜片上放出yL(标准状况)气体发生的电极方程式为:
2H++2e-=H2↑
2mol 22.4L
0.3mol y
y=3.36L,
答:铜片上放出3.36L(标准状况)气体;
(3)设硫酸的物质的量为z.
Fe+H2SO4=FeSO4+H2↑
1mol 22.4L
z 3.36L
所以z=0.15mol
C=$\frac{n}{V}$=$\frac{0.15}{0.05}$=3mol/L
答:原稀硫酸溶液的物质的量浓度3mol/L.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系是解本题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
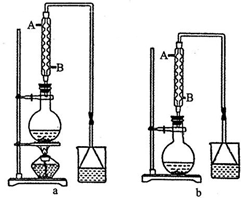 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
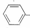 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: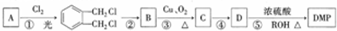
 .
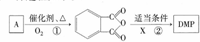
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量低的电子只能在s轨道上运动,能量高的电子总在f轨道上运动 | |
| B. | 电子的运动和行星相似,围绕着原子核在固定的轨道上高速旋转 | |
| C. | 同一能层中不同能级的能量高低相同 | |
| D. | M能层中含有3d能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{135}$I位于元素周期表中第4周期ⅦA族 | |
| B. | ⅦA族氢化物的沸点:HF<HCl<HBr<HI | |
| C. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 | |
| D. | ${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的两种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:X>Z>W | |
| C. | 最高价氧化物的水化物的酸性:W>Z | |
| D. | X可分别与W、Y形成化合物,其所含的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
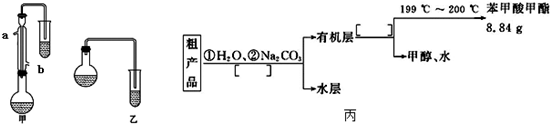
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com