
【题目】下列分子或离子中,不含孤电子对的是( )
A.H2OB.NH4+C.NH3D.H3O+
【答案】B
【解析】
根据中心原子的孤电子对数=![]() ,其中x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,氢为1,其他原子等于“8-该原子的价电子数”。
,其中x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,氢为1,其他原子等于“8-该原子的价电子数”。
注意:
(1)若微粒为分子,则a为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子数;
(2)若微粒为阳离子,则a为中心原子的价电子数减去离子的电荷数;
(3)若微粒为阴离子,则a为中心原子的价电子数加上离子的电荷数(绝对值)。
据此进行分析。
A.据中心原子的孤电子对数计算公式可知,H2O中的中心原子O原子的孤电子对数=![]() ,A项错误;
,A项错误;
B.据中心原子的孤电子对数计算公式可知,NH4+中的中心原子N原子的孤电子对数=![]() ,NH4+中不含孤电子对,B项正确;
,NH4+中不含孤电子对,B项正确;
C.据中心原子的孤电子对数计算公式可知,NH3中的中心原子N原子的孤电子对数=![]() ,C项错误;
,C项错误;
D.据中心原子的孤电子对数计算公式可知,H3O+中的中心原子O原子的孤电子对数=![]() ,D项错误;
,D项错误;
答案选B。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
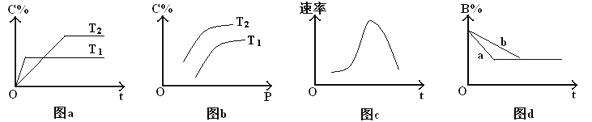
A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
A.测同温同浓度下的![]() 和
和![]() 水溶液的pH,确定碳和硫两元素非金属性强弱
水溶液的pH,确定碳和硫两元素非金属性强弱
B.向煮沸的1![]() NaOH溶液中滴加
NaOH溶液中滴加![]() 饱和溶液制备
饱和溶液制备![]() 胶体
胶体
C.用乙醇萃取碘水中的碘
D.证明铁的生锈与空气有关,可用图装置来证明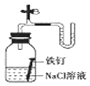
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是![]()
![]()
A.锅炉中沉积的![]() 可用
可用![]() 溶液浸泡后,再将不溶物用稀盐酸溶解去除
溶液浸泡后,再将不溶物用稀盐酸溶解去除
B.向沸水中滴加![]() 饱和溶液制备
饱和溶液制备![]() 胶体的原理是加热促进了
胶体的原理是加热促进了![]() 水解
水解
C.在室温下,向纯水中加入盐酸或氢氧化钠都能使水电离平衡逆向移动,但是水的离子积不变
D.反应![]() 在一定条件下能自发进行,说明该反应的
在一定条件下能自发进行,说明该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是( )
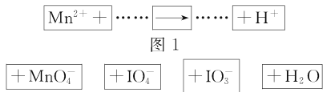
A.![]() 作氧化剂B.若有
作氧化剂B.若有![]() 参加反应转移
参加反应转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为5∶2D.配平后![]() 、
、![]() 的化学计量数分别为2、3
的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的简化核外电子排布式为__,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是___。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
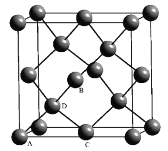

②晶胞参数,描述晶胞的大小和形状。已知单晶Ge的晶胞参数a=565.76pm,其密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:
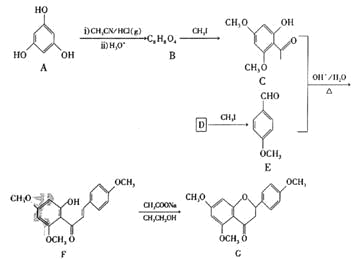
已知:![]()
![]()
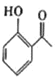 或
或![]()
回答下列问题:
![]() 的结构简式为________,其中所含官能团的名称为_______;B生成C的反应类型为_______。
的结构简式为________,其中所含官能团的名称为_______;B生成C的反应类型为_______。
![]() 的名称是________。
的名称是________。
![]() 由C和E合成F的化学方程式为________。
由C和E合成F的化学方程式为________。
![]() 的同分异构体中,能发生银镜反应且分子结构中含苯环的还有________种,其中核磁共振氢谱上有6组峰,峰面积之比为
的同分异构体中,能发生银镜反应且分子结构中含苯环的还有________种,其中核磁共振氢谱上有6组峰,峰面积之比为![]() 的同分异构体的结构简式为________
的同分异构体的结构简式为________![]() 写出一种即可
写出一种即可![]() 。
。
![]() 参照上述合成路线,以
参照上述合成路线,以![]() 为原料
为原料![]() 其他试剂任选
其他试剂任选![]() ,设计制备巴豆醛
,设计制备巴豆醛![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com