
 .
.| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
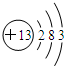
分析 (1)简单阳离子的电子式就是其离子符号;Al原子核外有13个电子分三层排布,核内有13个质子;
(2)同周期从左到右阳离子的半径逐渐减小;在短周期中非金属性最强的元素为F;
(3)a.元素的金属性与金属单质的熔点无关;
b.元素的金属性越强,其最高价氧化物的水化物的碱性越强;
c.常温下铝遇到浓硝酸会钝化;
d.令Na、Mg、Al的质量都为1g,根据n=$\frac{m}{M}$计算Na、Mg、Al的物质的量,金属提供电子的物质的量之比等于生成氢气的物质的量之比;
(4)同周期从左到右元素的非金属性逐渐增强;根据Al与Cl 的电负性差值判断.
解答 解:(1)简单阳离子的电子式就是其离子符号,则钠离子的电子式为Na+;Al原子核外有13个电子分三层排布,核内有13个质子,则Al原子的原子结构示意图为: ;
;
故答案为:Na+; ;
;
(2)同周期从左到右阳离子的半径逐渐减小,则钠、镁、铝元素的阳离子半径由小到大的顺序是Al3+<Mg2+<Na+;在短周期中非金属性最强的元素为F,F元素在周期表中位于第二周期、第VIIA族;
故答案为:Al3+<Mg2+<Na+;二、VIIA;
(3)a.元素的金属性与金属单质的熔点无关,金属单质的熔点与金属键的强弱有关,故错误;
b.元素的金属性越强,其最高价氧化物的水化物的碱性越强,则NaOH、Mg(OH)2、Al(OH)3的碱性依次减弱,故正确;
c.常温下铝遇到浓硝酸会钝化,在铝的表面形成致密的氧化膜,阻止反应进一步发生,故错误;
d.令Na、Mg、Al的质量都为1g,则:
1gNa的物质的量为$\frac{1}{23}$mol,1gNa提供电子物质的量为$\frac{1}{23}$mol×1=$\frac{1}{23}$mol,
1gMg的物质的量为$\frac{1}{24}$mol,1gMg提供电子物质的量为$\frac{1}{24}$mol×2=$\frac{1}{12}$mol,
1gAl的物质的量为$\frac{1}{27}$mol,1gAl提供电子物质的量为$\frac{1}{27}$mol×3=$\frac{1}{9}$mol,
金属提供电子的物质的量之比等于生成氢气的物质的量之比,即生成氢气物质的量之比为$\frac{1}{23}$:$\frac{1}{12}$:$\frac{1}{9}$=36:69:92,所以生成氢气的物质的量依次增加,故正确;
故答案为:b、d;
(4)同周期从左到右元素的非金属性逐渐增强,由表中数据可知,同周期从左到右元素的电负性逐渐增大,所以元素的电负性越大,其非金属性越强;
Cl的电负性为3.0,Al的电负性为1.5,二者的电负性差值为1.5,所以AlCl3中的化学键类型共价键;
故答案为:元素的电负性越大,其非金属性越强;共价键.
点评 本题考查了原子结构示意图、离子半径比较、电负性、金属与酸的反应、常见金属元素及其化合物的性质,题目涉及的知识点较多,侧重于考查学生的分析能力和对基础知识的应用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
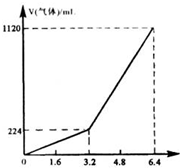 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(A-N+8)}{A+16}$ | B. | $\frac{n(A-N+10)}{(A+16)}$ | C. | A-N+2 | D. | $\frac{n(A-N+6)}{A}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2878KJ/mol | B. | 2658KJ/mol | C. | 1746KJ/mol | D. | 1526KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com