
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是一种弱电解质 | |
| B. | 金属钠着火不能用液态二氧化碳灭火 | |
| C. | 二氧化碳和水经“人工树叶”合成燃油,可实现由太阳能转变为化学能 | |
| D. | 用二氧化碳合成可降解的聚碳酸酯塑料,有利于遏制白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
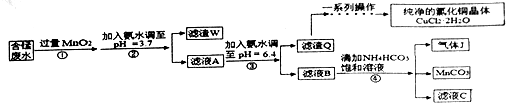
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 沉淀完全的pH | 9.7 | 3.7 | 6.4 | 10.4 |
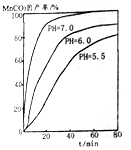
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减少环境污染,常使用乙醇汽油代替化石燃料,乙醇可通过纤维素转化制得,是一种可再生的燃料 | |
| B. | 优良的催化剂可以降低反应温度,起到节能效果并提高反应物的转化率 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
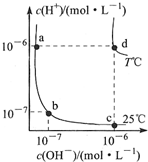
| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com