
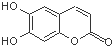
 中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A. | 2 mol Br2 2 mol NaOH | B. | 2 mol Br2 3 mol NaOH | ||
| C. | 3 mol Br2 4 mol NaOH | D. | 4 mol Br2 4 mol NaOH |
分析 该物质中含有酯基、酚羟基、苯环、碳碳双键,具有酚、酯和苯的性质,能发生显色反应、氧化反应、取代反应、水解反应及加成反应,酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,以此解答该题.
解答 解:酚羟基苯环上邻对位H原子能被溴原子取代,酯基能和NaOH水溶液发生水解反应,酚羟基和NaOH发生中和反应,碳碳双键和溴发生加成反应,1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,酯基水解生成的酚羟基和羧基都能和NaOH反应,消耗溴的物质的量为3mol、NaOH的物质的量为4mol,
故选C.
点评 本题考查有机物结构和性质,为高考高频点,明确物质官能团及其性质是解本题关键,注意酯基水解生成的酚羟基能和NaOH发生中和反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨燃料电池在放电时,氨气被氧化 | |
| B. | 氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-=N2+6H2O | |
| C. | 以氨气代替氢气的主要原因是:氨气易液化易储存 | |
| D. | 氨燃料电池产物为无污染的氮气和水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大D的浓度 | B. | 减小C的浓度 | C. | 减小B的浓度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 元素W位于第三周期第ⅤA族 | |
| B. | 元素Y的氢化物水溶液呈酸性 | |
| C. | 元素X、Z的各种氯化物分子中,各原子均满足8电子稳定结构 | |
| D. | 元素X与氢元素形成的原子个数比为1:1的化合物有多种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
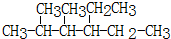 2,3-二甲基-3-乙基己烷
2,3-二甲基-3-乙基己烷 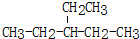 2-乙基戊烷
2-乙基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:实验题
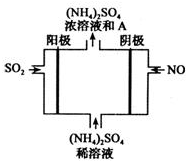 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com