
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,
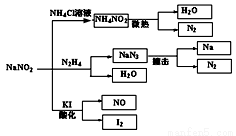
下列说法错误的是
A.上图所涉及到的化学反应都是氧化还原反应
B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
A
【解析】
试题分析:A、亚硝酸钠与氯化铵反应生成氯化钠和亚硝酸铵的反应是复分解反应,不是氧化还原反应,A错误;B、氮元素是活泼的非金属元素,因此N2H4与水分子间存在氢键,且N2H4是极性分子,所以N2H4极易溶于水,B正确;C、根据原子守恒和电子得失守恒可知NaNO2与N2H4生成NaN3的反应方程式为NaNO2 + N2H4 = NaN3 + 2H2O,C正确;D、亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,因此可以用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2),D正确,答案选A。
考点:考查氧化还原反应、物质溶解性以及物质检验的判断


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2014-2015北京市昌平区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应不属于氧化还原反应的是
A.木炭与浓硫酸反应 B.盐酸与氧化钙反应
C.铜与稀硝酸反应 D.铁粉与水蒸气反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:选择题
放射性元素碘131(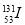 )和铯137(
)和铯137( )是核反应物中的主要元素。下列叙述正确的是
)是核反应物中的主要元素。下列叙述正确的是
A.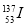 与
与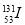 的所有性质都相同
的所有性质都相同
B. 原子中含有中子数比质子数多27
原子中含有中子数比质子数多27
C. 与
与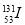 的中子数相同
的中子数相同
D.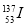 与
与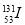 是同素异形体
是同素异形体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。

(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
(6)某电池放电时的总反应为:Fe+F2O3+3H2O = Fe(OH)2+2F(OH)2(注:F2O3和F(OH)2为上面F元素对应的化合物),写出该电池放电时正极反应式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
酸雨给人类带来了种种灾难,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能
A.①②④ B.①②③ C.①②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省眉山市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
下列关于物质分类的说法正确的是
A.Na2O2﹑CaO﹑K2O都是碱性氧化物 B.BaSO4﹑NaCl﹑KNO3溶液都是电解质
C.纯碱﹑烧碱﹑碱石灰都是碱 D.稀豆浆﹑果冻﹑淀粉溶液都是胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki = 3.6×10 – 4 ;
H3PO4的 Ki1= 7.5×10 -3,Ki2= 6.2×10 -8,Ki3= 2.2×10 -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
硝基苯中溶有少量CaCl2,适宜的提纯方法是
A.过滤 B.蒸馏 C.分液 D.纸上层析
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应: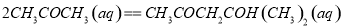 取相同浓度的
取相同浓度的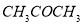 ,分别在40℃和60℃时,测得其转化率
,分别在40℃和60℃时,测得其转化率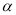 随时间变化的关系曲线(
随时间变化的关系曲线(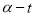 )如图所示。下列说法正确的是
)如图所示。下列说法正确的是
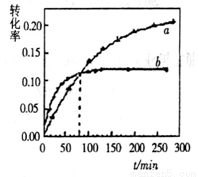
A.b代表40℃时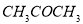 的
的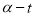 曲线
曲线
B.升高温度可缩短该反应达平衡的时间并能提高平衡转化率
C.增大压强可缩短该反应达平衡的时间并能提高平衡转化率
D.上述反应的逆反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com