
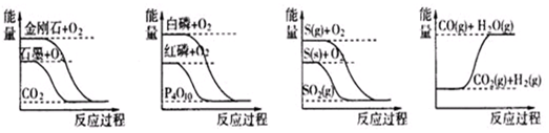
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,白磷比红磷稳定 | |
| C. | 相同条件下,等质量S(g)和S (s)的能量比较,S (s)能量较高 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2 (g)是吸热反应 |
分析 A.由图可知,金刚石的能量高于石墨的能量;
B.由图可知,生成物相同,反应物中白磷能量高于红磷能量;
C.生成物相同,反应物中气态S的能量大于固态S的能量;
D.由图可知,CO2(g)、H2(g)的总能量小于CO(g)、H2O(g)的总能量.
解答 解:A.图象分析金刚石能量高于石墨,石墨转变为金刚石是吸热反应,故A正确;
B.由图可知,生成物相同,反应物中白磷能量高于红磷能量,则红磷比白磷稳定,故B错误;
C.依据图象分析固体硫变化为气态硫需要吸收能量,相同条件下,等质量S(g)和S(s)的能量比较,S(s)较小,故C错误;
D.由图象可知该反应是能量升高的反应,CO2(g)+H2(g)是反应物,CO(g)+H2O(g)是生成物,为吸热反应,所以反应方程为CO2(g)+H2(g)=CO(g)+H2O(g)△H>0,所以其逆反应的△H<0,为放热反应,故D错误.
故选A.
点评 本题综合考查能量变化知识,为高频考点,侧重学生的分析能力的考查,注意对放热反应和吸热反应的理解和掌握,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(NH4+)相同的溶液中,溶质的物质的量浓度:c(NH3•H2O)>c(CH3COONH4)>c(NH4Cl)>c(NH4HSO4) | |
| B. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量盐酸大于醋酸 | |
| D. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极区溶液的pH增大 | |
| B. | 放电时,负极反应式为3Zn-6e-=3Zn2+ | |
| C. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 | |
| D. | 充电时,电池的锌电极接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机高分子化合物的相对分子质量很大,但其结构是若干链节的重复 | |
| B. | 生成有机高分子化合物的反应只有加聚反应 | |
| C. | 塑料、合成橡胶和合成纤维这三大合成材料,都主要是以石油、煤和天然气为原料生产的 | |
| D. | 聚乙烯塑料的主要成分聚乙烯是由石油裂解产物乙烯通过聚合反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 白磷比红磷稳定 | |
| C. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色固体粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 所有的有机物都很容易燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com