
某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用米汤检验含碘盐中的碘酸钾(KIO3)
B.用食醋除去暖水瓶中的薄层水垢
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
下列关于浓硫酸的叙述不正确的是( )
|
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 |
|
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
|
| C. | 浓硫酸是一种干燥剂,能够干燥二氧化硫、氢气等气体 |
|
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,
其中正确的是


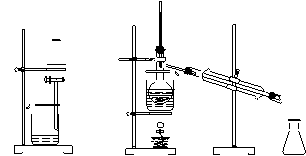

A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
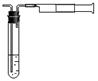
某化工厂设计要求为:空气中二氧化硫含量不得超过0.02 mg·L-1。
某同学拟用下图所示简易装置测定空气中的SO2含量:准确移取10mL 5×10-4 mol·L-1的标准碘水溶液,注入试管中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止。假设该同学的测量是准确的,则他抽气的次数至少为 次时方可说明该厂空气中的SO2含量达标。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上有许多方法可以用于
鉴别食盐和“工业盐”,下列方法可行的是:
①加入稀硫酸,微热,看能否产生红棕色气体。②加入酸化的碘化钾淀粉溶液,看溶液是否变蓝。③加入酸化的氯化亚铁溶液,看溶液是否变成棕黄色。④加入酸性高锰酸钾溶液,看能否褪色。⑤加入硝酸酸化的硝酸银溶液,看能否产生白色沉淀。
A.只有①②③④ B.只有②③④⑤ C.只有③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
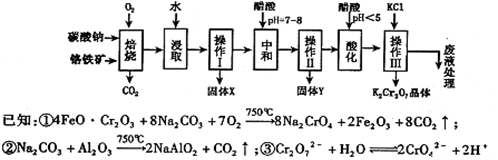
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 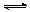 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。

(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列结论均出自《实验化学》中的实验,其中不正确的是
A.硫酸铜溶液中加入过量浓氨水,可得到深蓝色透明溶液
B.NaCl溶液热发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
C.实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取
D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风 湿性关节炎的药物,可通过以下方法合成:
湿性关节炎的药物,可通过以下方法合成:
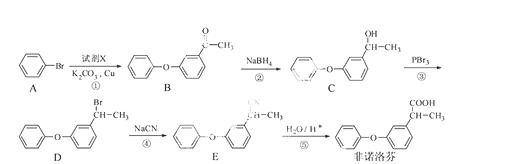
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以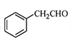 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
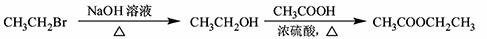
查看答案和解析>>
科目:高中化学 来源: 题型:
被称之为“软电池”的纸质电池总反应为Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是 ( )
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:MnO2+e-+H2O=MnOOH+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com