
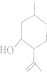
 )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).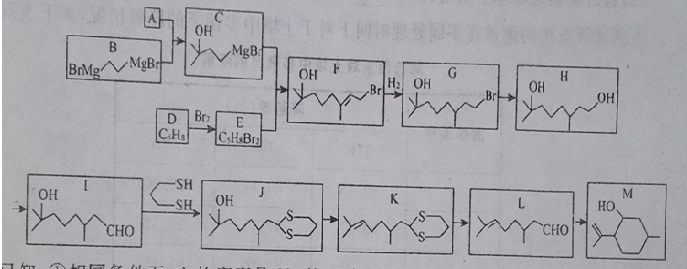
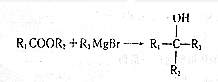
 .
.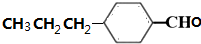 (写出其中任意一种的结构简式).
(写出其中任意一种的结构简式).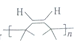 的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ (无机试剂任选).
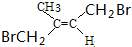
(无机试剂任选). 分析 (1)A的密度是H2的37倍,则其相对分子质量为74,比较B和C的结构简式可知,A与B发生信息②中的反应,则A为CH3COOCH3,根据A的结构简式可知A中官能团的名称;比较F和C的结构简式,结合E的分子可知,E为BrCH2C(CH3)=CHCH2Br,D与溴发生加成得E,所以D为CH2=C(CH3)-CH=CH2,据此答题;
(2)比较F和G的结构简式可知,F与氢气发生加成反应得G,比较J和K的结构简式可知,J发生消去反应得K;
(3)G→H的反应卤代烃的碱性水解,据此书写化学方程式;
(4)根据条件①六元环上连接2个取代基,②能发生银镜反应,说明有醛基,结合M的结构简式可以判断其同分异构体的种类,其中核磁共振极谱有8个吸收峰,即有8种位置的氢,且峰面积之比为l:l:1:2:2:3:4:4,即8种氢的个数比为l:l:1:2:2:3:4:4,据此书写结构;
(5)由A和B为起始原料,发生1,4一加聚反应制备 ,可以用两分子A与一分子B发生信息②中的反应得到(CH3)C(OH)C(OH)(CH3)2,(CH3)C(OH)C(OH)(CH3)2再发生消去反应得到CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)-C(CH3)=CH2发生1,4一加聚反应得到
,可以用两分子A与一分子B发生信息②中的反应得到(CH3)C(OH)C(OH)(CH3)2,(CH3)C(OH)C(OH)(CH3)2再发生消去反应得到CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)-C(CH3)=CH2发生1,4一加聚反应得到 ,据此答题.
,据此答题.
解答 解:(1)A的密度是H2的37倍,则其相对分子质量为74,比较B和C的结构简式可知,A与B发生信息②中的反应,则A为CH3COOCH3,根据A的结构简式可知A中官能团的名称为酯基,比较F和C的结构简式,结合E的分子可知,E为BrCH2C(CH3)=CHCH2Br,D与溴发生加成得E,所以D为CH2=C(CH3)-CH=CH2,D的化学名称为2-甲基-1,3-丁二烯,E的反式结构简式为 ,
,
故答案为:酯基;2-甲基-1,3-丁二烯; ;
;
(2)比较F和G的结构简式可知,F与氢气发生加成反应得G,比较J和K的结构简式可知,J发生消去反应得K,
故答案为:加成反应;消去反应;
(3)G→H的反应卤代烃的碱性水解,反应的化学方程式为(CH3)C(OH)CH2CH2CH2CH(CH3)CH2CH2Br+NaOH$\stackrel{△}{→}$(CH3)C(OH)CH2CH2CH2CH(CH3)CH2CH2OH+NaBr,
故答案为:(CH3)C(OH)CH2CH2CH2CH(CH3)CH2CH2Br+NaOH$\stackrel{△}{→}$(CH3)C(OH)CH2CH2CH2CH(CH3)CH2CH2OH+NaBr;
(4)根据条件①六元环上连接2个取代基,②能发生银镜反应,说明有醛基,结合M的结构简式可以判断其同分异构体为六元环上连有-CHO、-CH2CH2CH3,或-CHO、-CH(CH3)2,或-CH2CHO、-CH2CH3,或-CH2CH2CHO、-CH3,或-CH(CH3)CHO、-CH3,每种连结位置都有4种,所以共有20种,其中核磁共振极谱有8个吸收峰,即有8种位置的氢,且峰面积之比为l:l:1:2:2:3:4:4,即8种氢的个数比为l:l:1:2:2:3:4:4的结构为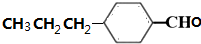 ,
,
故答案为:20;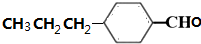 ;
;
(5)A的密度是H2的37倍,则其相对分子质量为74,比较B和C的结构简式可知,A与B发生信息②中的反应,则A为CH3COOCH3,由A和B为起始原料,发生1,4一加聚反应制备 ,可以用两分子A与一分子B发生信息②中的反应得到(CH3)C(OH)C(OH)(CH3)2,(CH3)C(OH)C(OH)(CH3)2再发生消去反应得到CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)-C(CH3)=CH2发生1,4一加聚反应得到
,可以用两分子A与一分子B发生信息②中的反应得到(CH3)C(OH)C(OH)(CH3)2,(CH3)C(OH)C(OH)(CH3)2再发生消去反应得到CH2=C(CH3)-C(CH3)=CH2,CH2=C(CH3)-C(CH3)=CH2发生1,4一加聚反应得到 ,合成路线为2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
,合成路线为2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ .
.
点评 本题考查有机物的推断,题目难度中等,本题注意把握有机物官能团的性质和转化,结合反应条件判断可能发生的反应,特别是有机物官能团的性质,为解答该类题目的关键,(5)为易错点,注意理解流程中的信息.


科目:高中化学 来源: 题型:选择题
| A. | 3:1:1 | B. | 2:2:1 | C. | 3:4:3 | D. | 7:13:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2完全燃烧生成气态水,放出241.8 kJ热量,H2的燃烧热△H=-241.8 kJ/mo1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mo1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 热化学方程式中,化学式前面的化学计量数可表示微粒数,不可表示物质的量 | |
| D. | 已知:C(金刚石,s)=C(石墨,s)△H<0,因此金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与苯酚都能与溴水发生取代反应 | |
| B. | 苯酚与苯甲醇(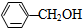 )组成相差一个-CH2-原子团,因而它们互为同系物 )组成相差一个-CH2-原子团,因而它们互为同系物 | |
| C. | 在苯酚溶液中,滴入几滴FeCl3溶液,溶液立即呈紫色 | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上5个氢原子都容易取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl-CH2-CH2Cl | B. | CHCl2-CH2-CH3 | C. | CH2Cl-CHCl-CH3 | D. | CH3-CCl2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素的原子序数越大,其原子半径越大 | |
| B. | 在元素周期表中,元素所在的周期数等于原子核外电子数 | |
| C. | 最外层电子数为8的微粒是稀有气体元素的原子 | |
| D. | 在元素周期表中,元素所在族的族序数等于原子核外最外层电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com