
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
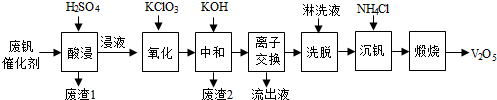
分析 从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-$?_{洗脱}^{离子交换}$R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应逆向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答.
解答 解:从废钒催化剂中回收V2O5,由流程可知,“酸浸”时V2O5转化为VO2+,V2O4转成VO2+.氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,然后加氧化剂KClO3,将VO2+变为VO2+,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-$?_{洗脱}^{离子交换}$R4V4O12+4OH-,由ROH为强碱性阴离子交换树脂可知,碱性条件下利用反应正向移动,流出液中主要为硫酸钾,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,由上述分析可知滤渣1为SiO2,
故答案为:V2O5+2H+=2VO2++H2O;SiO2;
(2)“氧化”中欲使3 mol的VO2+变为VO2+,由电子守恒可知,则需要氧化剂KClO3至少为$\frac{3mol×(5-4)}{[5-(-1)]}$=0.5mol,
故答案为:0.5;
(3)由上述流出分析可知滤渣2为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(4)利用强碱性阴离子交换树脂可“离子交换”和“洗脱”,则应选择碱性条件下使用,且OH-浓度大反应逆向移动提高洗脱效率,故答案为:碱;
(5)由上述分析可知,流出液中主要为硫酸钾,则“流出液”中阳离子最多的是K+,故答案为:K+;
(6)“煅烧”中发生反应的化学方程式为2NH4VO3$\frac{\underline{\;高温\;}}{\;}$V2O5+H2O↑+2NH3↑,故答案为:2NH4VO3$\frac{\underline{\;高温\;}}{\;}$V2O5+H2O↑+2NH3↑.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中发生的反应、混合物分离及实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验相结合的训练,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
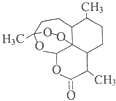 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )| A. | 青蒿素分子中含有醚键和酯基等官能团 | |
| B. | 青蒿素在加热时能与NaOH的水溶液反应 | |
| C. | 青蒿素易溶于水、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管压强小于外压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1000 | B. | 1011:1010:10:1 | C. | 1:10:1010:1011 | D. | 14:13:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1molNH3•H2O | |
| B. | 溶液中NH3的物质的量浓度为0.2mol•L-1 | |
| C. | NH3和NH3•H2O的物质的量浓度之和为0.2mol•L-1 | |
| D. | NH3、NH3•H2O和NH4+的物质的量之和为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、W的简单阴离子具有相同的电子层结构 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | 原子半径:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com