
分析 根据电池反应式知,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,
(1)失电子化合价升高的金属单质作负极,得电子化合价降低的电解质溶液为电解液;
(2)电子从负极沿导线流向正极;
(3)负极上失电子发生氧化反应;
(4)正极上得电子发生还原反应,该原电池中正极上氢离子得电子生成氢气.
解答 解:根据电池反应式知,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,
(1)失电子化合价升高的金属单质作负极,得电子化合价降低的电解质溶液为电解液,根据电池反应式知,Zn失电子作负极,稀硫酸是电解质溶液,
故答案为:锌片;稀硫酸;
(2)负极上失电子、正极上得电子,所以电子从负极沿导线流向正极,故答案为:负;正;
(3)负极上失电子发生氧化反应,根据电池反应式知,负极上Zn失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(4)该原电池中正极上氢离子得电子生成氢气,所以正极上发生还原反应,看到的现象是有气泡生成,
故答案为:还原;有气泡产生.
点评 本题考查原电池设计,侧重考查原电池原理及知识运用能力,原电池反应中化合价升高的金属单质作负极、得电子的可溶性电解质溶液为原电池电解质溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
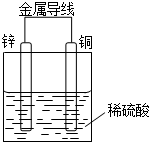 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告查看答案和解析>>
科目:高中化学 来源: 题型:解答题
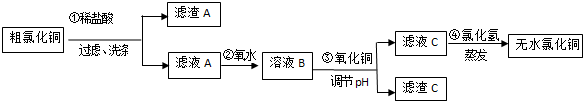
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | Al在氧气中燃烧生成A12O3,将Al片改成Al粉 | |
| D. | Na与水反应时增大水的用量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
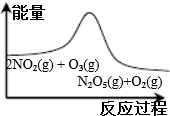 | 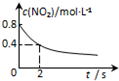 |  | 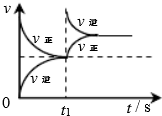 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com