
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅可用于制取光导纤维 | |
| C. | 为防止富脂食品氧化变质,在包装袋中放入生石灰 | |
| D. | 钠、钾、铁等金属有绚丽的颜色,可用于制造焰火 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
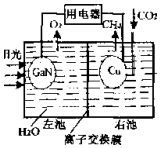 太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )| A. | 该装置系统中只存在两种能量转化 | |
| B. | Cu电极上的电极反应为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 离子交换膜为质子交换膜,H+从右池移向左池 | |
| D. | 常温下,当装置中有1mol CH4生成时,GaN电极有 44.8LO2生成(不考虑O2的溶解性) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L CHCl3 中含有的分子数为 0.5NA | |
| B. | 1mol H218O 中含有的中子数为 10NA | |
| C. | 46g C2H5OH 中含有的共价键数目为 7NA | |
| D. | 1L 1mol/L CH3COONa 溶液中含 CH3COO-的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 用灼烧法可鉴别毛笔羊毫的真伪 | 用墨写字画画可长久不褪色 | 纸及造纸原料的主要成分均是纤维素 | 用石材制作砚台的过程是化学变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
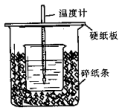 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com