

分析 (1)某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,结合三行计算列式,
2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)
起始量(mol) 4 2 0 0
变化量(mol) 2 1 1 1
平衡量(mol) 2 1 1 1
①25-40s内,根据图1,25s时,氨气浓度为25×10-3mol/L,40s达到平衡,根据三段式,平衡时氨气的浓度为$c=\frac{2mol}{100L}=0.02mol/L$,25-40s内,氨气的浓度变化量为△c=25×10-3-0.02=5×10-3mol/L,平均化学反应速率为$\overline{r}=\frac{△c}{△t}$;
②根据平衡常数的表达式$K=\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$,代入数据计算即可;
③反应40s时已经达到平衡,40-60s内是一条水平线;催化剂能缩短反应到达平衡的时间,但不能改变化学反应的平衡状态,据此作图;
(2)c线表示的是平衡体系中尿素的百分含量,尿素的百分含量越大,则尿素的量也越大;
(3)联系常用提高反应物转化率的方法:增加原料的量,温度变化,压强变化等;
(4)①N极电极处O2转化为H2O,这个过程中O2是得到电子的,因此N极应为原电池正极,M电极就为原电池负极,电极反应应为CO(NH2)2失去电子被氧化,考虑到转化为环境友好型物质,则产物为CO2,N2和H2O;
②N极消耗标准状况下33.6L气体,即1.5molO2,根据电子守恒,计算M极理论上处理的尿素的量.
解答 解:(1)①25-40s内,根据图1,25s时,氨气浓度为25×10-3mol/L,根据三段式的结果,平衡时,即40s时,氨气浓度为$c=\frac{2mol}{100L}=0.02mol/L$,则氨气在25-40s内浓度变化量为△c=25×10-3-0.02=5×10-3mol/L,因此氨气的化学反应平均速率为$\overline{r}=\frac{△c}{△t}=\frac{5×1{0}^{-3}mol/L}{15s}=3.3×1{0}^{-4}$mol/(L•s).故答案为:3.3×10-4mol/(L•s).
②反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g),该反应的平衡常数为$K=\frac{c({H}_{2}O)}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$,根据三段式结果,平衡时,$c(N{H}_{3})=\frac{2mol}{100L}=0.02mol/L$,$c(C{O}_{2})=\frac{1mol}{100L}=0.01mol/L$,$c({H}_{2}O)=\frac{1mol}{100L}=0.01mol/L$,代入计算得$K=\frac{0.01mol/L}{0.01mol/L×(0.02mol/L)^{2}}$=2500L2/mol2.故答案为:2500L2/mol2.
③反应到达40s时已经达到了平衡,40s-60s内,各组分浓度已经不再发生变化了,图象是一条水平线,平衡时候,$c(N{H}_{3})=20×1{0}^{-3}mol/L$,当使用催化剂时,催化剂能缩短反应到达平衡时的时间,但不改变平衡的状态,即平衡时候各组分浓度与未使用催化剂时完全一致.图象为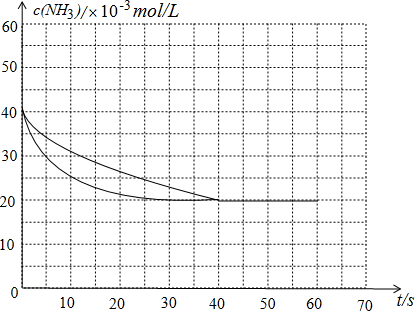 ,
,
故答案为: .
.
(2)c线表示的是平衡体系中尿素的百分含量,尿素的百分含量越大,则尿素的量也越大,尿素的产率也就越高,结合图象来看,当氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}=2$时,c线上最最高点,此时尿素的百分含量最高,尿素的产率也最高,产量为最大.故答案为:2;
(3)常用提高反应物转化率的方法:增加原料的量,温度变化,压强变化,因此工业上为提高尿素的产率,反应的焓变△H<0,降低温度有利于反应正向进行;反应也为气体数减小的反应,降低压强也可促使平衡向右移动,可采取的措施有增大反应物浓度、增大压强、降低温度.故答案为:增大反应物浓度、增大压强、降低温度;
(4)①N极电极处O2转化为H2O,这个过程中O2是得到电子的,因此N极应为原电池正极,M电极就为原电池负极,电极反应应为CO(NH2)2失去电子被氧化,考虑到转化为环境友好型物质,则产物为CO2,N2和H2O,电极反应方程式为:$CO(N{H}_{2})_{2}+{H}_{2}O-6{e}^{-}$═$C{O}_{2}↑+{N}_{2}↑+6{H}^{+}$.故答案为:正,$CO(N{H}_{2})_{2}+{H}_{2}O-6{e}^{-}$═$C{O}_{2}↑+{N}_{2}↑+6{H}^{+}$;
②N极的电极反应方程式为:${O}_{2}+4{e}^{-}+4{H}^{+}=2{H}_{2}O$,根据电子守恒,存在反应关系为3O2~~~~~~2CO(NH2)2,消耗33.6LO2,即消耗氧气为$n({O}_{2})=\frac{33.6L}{22.4L/mol}=1.5mol$,则理论上可以处理尿素的物质的量为$n[(CO(N{H}_{2})_{2}]=1.5mol×\frac{2}{3}=1mol$,其质量为m=1mol×60g/mol=60g.故答案为:60.
点评 本题考察了化学平衡三段式的应用,化学平衡常数的计算,化学平衡的移动,电化学的相关知识,题目较为综合,难度不大,是基础题.需注意,实验平衡常数是有单位的,需要带单位进行计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:A<B<D | |
| B. | A与B形成的化合物溶于水后溶液呈碱性 | |
| C. | 氧化物的水化物的酸性一定是D>C | |
| D. | 气态氢化物沸点A大于C是因为H-A键比H-C键稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | X完全燃烧后生成CO2和H2O的物质的量比为1:1 | |
| D. | 分子式为 C5H10O2且能与NaHCO3溶液反应生成气体的物质有5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com