
| A. | 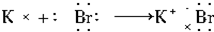 | |
| B. | 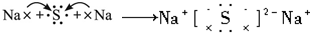 | |
| C. | 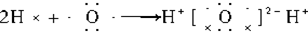 | |
| D. |  |
分析 A、KBr为离子化合物,由钾离子和溴离子构成;
B、硫化钠为离子化合物,根据离子化合物的电子式结合电子转移然后写出Na2S的形成过程;
C、水为共价化合物,两个氢原子分别与氧原子形成共价键;
D、电子式中,相同离子不能合并.
解答 解:A、KBr为离子化合物,由钾离子和溴离子构成,故其形成过程为 ,故A错误;
,故A错误;
B、硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ,故B正确;
,故B正确;
C、水为共价化合物,两个氢原子分别与氧原子形成共价键,H2O的形成过程: ,故C错误;
,故C错误;
D、氯化钙为离子化合物,且电子式中,相同离子不能合并,故用电子式表示下列物质的形成过程为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了用电子式表示物质的形成过程,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别,能够用电子式正确表示化合物的形成过程.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:多选题
| A. | CH3-CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3COCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
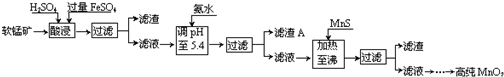
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘 遇淀粉变蓝 | B. | 钠 的焰色反应为黄色 | ||
| C. | 矿泉水中含有钙、镁等矿物质 | D. | 磷的同素异形体有红磷、白磷等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;(任写一种)
;(任写一种)

 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com