
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
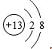
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物不一定符合同一通式 | |
| B. | 同分异构体不一定具有相同的最简式 | |
| C. | 相对分子质量相等的两种有机物必定是同分异构体 | |
| D. | 同分异构体间不一定有相似的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
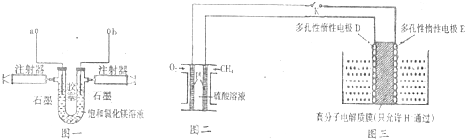
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
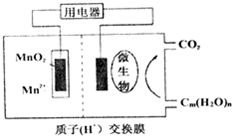 关于如图微生物燃料电池结构示意图的说法:
关于如图微生物燃料电池结构示意图的说法:| A. | ④ | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸常温下可与铜片迅速反应生成二氧化硫气体 | |
| C. | 浓硫酸是一种常用的干燥剂,可用来干燥氢气、氨气等 | |
| D. | 浓硫酸具有强氧化性,常温时可使铁、铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题:
A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题: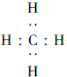 ,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.
,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com