
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH,现有①氯化氢②溴水③纯碱溶液④乙醇⑤酸性高锰酸钾溶液,根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A. 只有②④⑤ B. 只有①③④ C. 只有①②③⑤ D. ①②③④⑤
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的叙述不正确的是( )
A. 甲烷是最简单的有机物
B. 甲烷是天然气的主要成分
C. 甲烷能与氯气在光照条件下发生反应
D. 甲烷能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次性电池。该电池反应原理如图所示,其中电解质LiC1O4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。下列说法正确的是

A. 外电路的电流方向是由Li极流向MnO2极
B. 正极的电极反应式:MnO2+Li++e-=LiMnO2
C. Li电极发生还原反应
D. 在放电过程中ClO4-向正极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.lmol·L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. H2A为二元弱酸,其电离方程式为:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-
H++A2-
B. 在0.lmolL-1NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 在pH=1.2时,向H2A溶液中加入一定体积的0.lmo l·L-1的NaOH溶液使pH=4.2,则c(A2-)、c(HA-)、c(H2A)之和不变
D. 在 pH=3.0 时:c(A2-)+ c(HA-)<0.lmo l·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)该反应中发生还原反应的物质是__________。氧化产物是___________。
(2)用双线桥标出方程式中的电子得失___________。
2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)当有0.2mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何解决好碳排放问题是关系到人类可持续发展的重大课题之一。目前,采用较多的方法是对二氧化碳进行捕集封存和富集再利用。下列与二氧化碳有关的叙述正确的是
A. CO2是形成酸雨的主要物质
B. CO2导致温室效应,是一种大气污染物
C. CO2(g)+C(s) ![]() 2CO(g)
2CO(g) ![]() H>0,高温有利于该反应自发进行
H>0,高温有利于该反应自发进行
D. 实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果改变影响平衡的一个条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动,得出此规律的科学家是谁?
A.门捷列夫B.范德华C.勒夏特列D.盖斯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g由氧气和臭氧组成的混合物中含有氧原子的数目为0.3NA
B. 0.1 molL-1的FeCl3溶液中Cl-的数目为0.3NA
C. 标准状况下,11.2L苯中含有碳碳双键的数目为1.5NA
D. 1 mol Cl2与足量的铁反应转移的电子数是2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某研究性学习小组为探究Fe3+与Ag反应,进行如下实验。按下图连接装置并加入药品(盐桥中的物质不参与反应)。
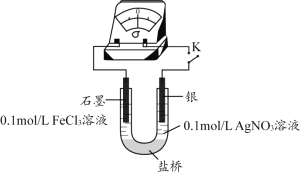
① K闭合时,指针向左偏转,石墨作___________(填“正极”或“负极”)。
② 当指针归零后,向左侧U型管中滴加几滴 FeCl2 浓溶液,发现指针向右偏转,写出此时银电极的反应式___________。
③ 结合上述实验分析,写出Fe3+ 和Ag反应的离子方程式__________。
④ 丙同学进一步验证其结论:当指针归零后,向右侧U型管中滴加数滴饱和NaCl溶液,可观察到的现象是___________。
(2)某锂离子电池,充电时阴极发生的反应为,6C+xLi++xe-=LixC6,阳极LiFePO4转化为FePO4,写出该锂离子电池放电时正极电极方程式___________,放电时总反应的化学方程式_____________。
(3)氨氧燃料电池具有很大的发展潜力,氨氧燃料电池工作原理如下图所示。
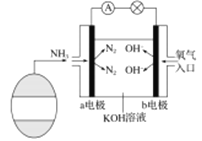
①a电极的电极反应式是____________;标准状况下b电极通入5.6LO2,测得电路中转移0.6mol电子,则O2的利用率为_______。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____________。
③联氨和N2O4可作为火箭推进剂。已知下列各反应的热化学方程式:
2O2(g)+N2(g) =2NO2(g) △H1
N2(g)+2H2(g)=N2H4(g) △H2
O2(g)+2H2(g)=2H2O(g) △H3
2N2H4(l)+ N2O4(g) =3N2(g)+4H2O(g) △H4=-1048.9kJ·mol-1
上述反应热效应之间的关系式为△H4=____________。
联氨和N2O4可作为火箭推进剂的主要原因为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com