
| A、铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | ||||
| B、二氧化硫与足量烧碱溶液反应:S02+20H-=S032-+H20 | ||||
| C、醋酸溶液与氢氧化钠溶液反应:H++OH-=H20 | ||||
D、浓盐酸与MnO2反应制Cl2:Mn02+2H++2C1-
|
| ||


科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10g NH3含有4NA个电子 |
| B、0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA |
| C、标准状况下,22.4L H2O中分子数为NA个 |
| D、1L 0.1mol?L-1 Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
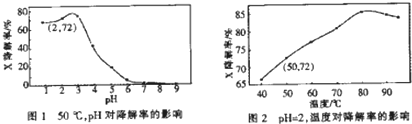
| A、50℃,PH在3~6之间,X降解率随PH增大而减小 |
| B、PH=2,温度在40~80℃,X降解率温度升高而增大 |
| C、无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80℃ |
| D、PH=2、温度为50℃,10min内v(X)=1.44×10-4mol?L-1min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L的H2O中含有的分子数为NA |
| B、常温常压下,48g O3与O2混合气体中含氧原子数为3NA |
| C、12g Mg与足量稀盐酸反应转移的电子数为2NA |
| D、1L 1mol?L-1Na2CO3溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) |
| B、同浓度的下列溶液中,①NH4HSO4 ②NH4Cl③NH3?H2O c(NH4+)由大到小的顺序是:②>①>③ |
| C、0.2 mol?L-1 CH3COOH溶液和0.2 mol?L-1 CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol?L-1 |
| D、0.1mol/LNaHS溶液:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入少量的C02气体:C02+H20+2C6H5O-→C6H50H+2C032- | |||
B、在硫酸作催化剂、加热条件下乙烯与水发生加成反应:CH2=CH2+H20
| |||
C、葡萄糖溶液与碱性氢氧化铜悬浊液混合后水浴加热:C6H12O6+2Cu(OH)2+NaOH
| |||
D、2分子甘氨酸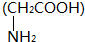 脱去2分子水: 脱去2分子水: |
查看答案和解析>>
科目:高中化学 来源: 题型:
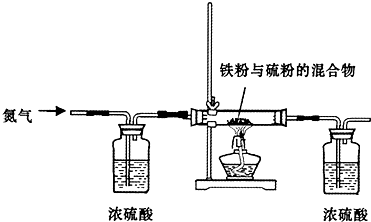
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com