��������1�����ݷ�Ӧ�Ȼ�ѧ����ʽ������CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol����Ӧ�ʱ�Ϊ��ֵ���Ƿ��ȷ�Ӧ���γɻ�ѧ���ų����������ڶ��ѻ�ѧ�����յ�������
��2�������Ȼ�ѧ����ʽ��ʽ��������һ����̼�����ʵ��������ת���ʼ���õ���
��3�����ݷ�Ӧ����ʼ���Ƿ�Ӧ����ʼ����2����Ũ�ȸı䣬ƽ�ⳣ�����䣬���÷�Һ������ƽ��Ũ�Ƚ��ƽ�ⳣ���������õ�ƽ�ⳣ����
��4������ƽ���ƶ�ԭ���ͷ�Ӧ���������ж�ѡ�
��5�������Ȼ�ѧ����ʽ��˹���ɼ���õ������û�ѧ����ʽ��
��6�����ݶ�����̼���ʵ����������������ʵ���������ϵ�����г��������ֱƽ��д����Ӧ�����ӷ���ʽ��
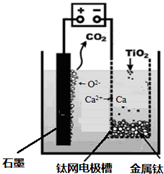
��7��������װ��ͼ�����жϣ��������ɶ�����̼���壬�ǵ�����е�������ʧ������������������������ʯī��Ӧ���ɵĶ�����̼��
���Ʊ�TiO
2ʱ���ڵ��۷������·�Ӧ��������2Ca
2++4e
-�T2Ca ������2O
2--4e
-�TO
2����2Ca+TiO
2Ti+2CaO���ɴ˿ɼ���CaO�������䣮
���
�⣺��1����Ӧ�ʱ�=��Ӧ����ѻ�ѧ����������-�����ﻯѧ���γɷų���������CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol����Ӧ�ʱ�Ϊ��ֵ���Ƿ��ȷ�Ӧ���γɻ�ѧ���ų����������ڶ��ѻ�ѧ�����յ�������
�ʴ�Ϊ��С�ڣ�
��2�����ݷ�Ӧ�Ļ�ѧ����ʽ��
CO��g��+H
2O��g��?CO
2��g��+H
2��g������H=-41kJ/mol
1mol 41KJ
n��CO�� 32.8 kJ
n��CO��=
��1mol=0.8mol��
һ����̼ת����=
��100%=80%��
�ʴ�Ϊ��80��
��3��CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol����Ӧ���� 32.8 kJ����һ����̼0.8mol����������ʽ��ʽ����ƽ��Ũ�ȣ����ڷ���ǰ��ϵ����ͬ�������������ʵ�������ƽ��Ũ�ȼ���ƽ�ⳣ����
CO��g��+H
2O��g��?CO
2��g��+H
2��g��
��ʼ����mol�� 1 4 0 0
�仯����mol�� 0.8 0.8 0.8 0.8
ƽ������mol�� 0.2 3.2 0.8 0.8
K=
=1��
�ʴ�Ϊ��1��
��4��a����Ӧǰ������������䣬��Ӧ�ٺͷ�Ӧ�ڴﵽ��ͬ��ƽ��״̬��ƽ��ʱ����������H
2�����������ȣ���a��ȷ��
b���������з�Ӧ��ƽ��״̬ʱ��ƽ�ⲻ�䣬��Ӧ����Q=65.6kJ����b����
c����Ӧ��ʼʱ����ʼ������Ũ�Ȳ�ͬ���������з�Ӧ�Ļ�ѧ��Ӧ���ʲ���ȣ���c����
d���������У���ѧ��Ӧ����Ϊ��v��H
2O��=V��CO��=
=
mol/��L?min������d����
�ʴ�Ϊ��a��
��5�������Ȼ�ѧ����ʽ��CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol
��2H
2��g��+O
2��g��=2H
2O ��g����H=-484kJ/mol��
��ϸ�˹���ɼ���١�2+�ڵõ�2CO��g��+O
2��g���T2CO
2��g����H=-566 kJ/mol��
�ʴ�Ϊ��2CO��g��+O
2��g���T2CO
2��g����H=-566 kJ/mol��
��6��CO
2�����ʵ���Ϊ0.6mol������200mL 5mol/L��NaOH��Һ������ȫ���գ������������ʵ���Ϊ0.2L��5mol/L=1mol��
CO
2+2NaOH=Na
2CO
3+H
2O��CO
2+NaOH=NaHCO
3��n��CO
2����n��NaOH��=1��2��Ӧ����̼���ƣ�n��CO
2����n��NaOH��=1��1����Ӧ����̼�����ƣ������n��CO
2����n��NaOH��=0.6��1=3��5���������ɲ�����̼���ƺ�̼�����ƣ���Ӧ�����ӷ���ʽΪ3CO
2+5OH
-�T2CO
32-+HCO
3-+2H
2O��
�ʴ�Ϊ��3CO
2+5OH
-�T2CO
32-+HCO
3-+2H
2O��
��7���٣�����ʯī������������������������CaF
2-CaO������ʣ���������������Ӧ�����������ƽ���������ԭ��Ӧ������ͼʾ����ɿ�֪���������ɶ�����̼���壬�ǵ�����е�������ʧ������������������������ʯī��Ӧ���ɵĶ�����̼�����Ե缫��ӦΪ��2O
2--4e
-=O
2����C+2O
2--4e
-=CO
2����
�ʴ�Ϊ��2O
2--4e
-=O
2����C+2O
2--4e
-=CO
2����
���Ʊ�TiO
2ʱ���ڵ��۷������·�Ӧ��2CaO�T2Ca+O
2����2Ca+TiO
2Ti+2CaO���ɴ˿ɼ���CaO�������䣻
���Ʊ�TiO
2ʱ���ڵ��۷������·�Ӧ��������2Ca
2++4e
-�T2Ca ������2O
2--4e
-�TO
2����2Ca+TiO
2 Ti+2CaO���ɴ˿ɼ���CaO�������䣻
�ʴ�Ϊ���Ʊ�TiO
2ʱ���ڵ��۷������·�Ӧ��2CaO�T2Ca+O
2����2Ca+TiO
2Ti+2CaO���ɴ˿ɼ���CaO�������䣮

 ��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������
��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
