
| A. | 硝基苯和水 | B. | 苯和甲苯 | C. | 乙苯和水 | D. | 溴苯和NaOH溶液 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯酸酯的单体的结构简式为:CH2=CH-COOR | |
| B. | 聚丙烯酸酯在一定条件下能发生加成反应 | |
| C. | 聚丙烯酸酯不能发生水解反应 | |
| D. | 聚丙烯酸酯有固定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
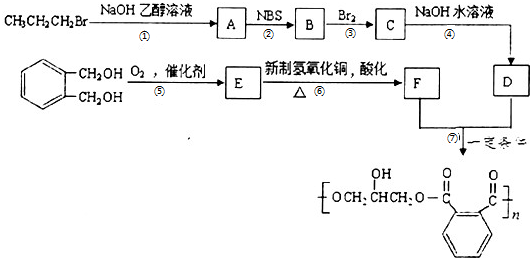
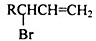
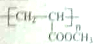 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: 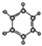 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的系统命名为2-甲基戊烷;.
的系统命名为2-甲基戊烷;. ③白磷 ④18O ⑤
③白磷 ④18O ⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com