
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
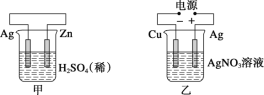
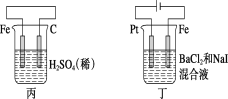
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
【答案】C
【解析】
由图可知:甲图为原电池,其中Zn为负极,失去电子,生成Zn2+;乙图为电解池,银与电源的正极相连接,为阳极,发生氧化反应;丙图为原电池,铁作负极,失去电子发生氧化反应,电解液中的H+得到电子,发生还原反应;丁图为电解池,铁与电源的负极相连,为阴极,Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应。
A. 甲图中Zn为负极,失去电子,生成Zn2+,电极反应式为:Zn-2e-= Zn2+,A项错误;
B. 乙图中银与电源的正极相连接,为阳极,发生氧化反应。乙中阳极反应式为Ag-e-=Ag+,B项错误;
C. 丙中铁作负极,失去电子发生氧化反应,电解液中的H+得到电子向正极移动,即H+向碳棒方向移动,C项正确;
D. 丁图中Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应,D项错误;
答案选C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是( )
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C.2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为419.6℃,沸点907℃。
I.图是古代以炉甘石(ZnCO3)为原料炼锌的示意图。
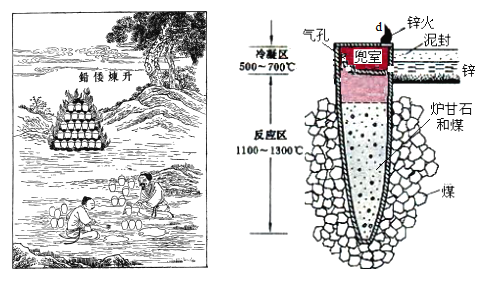
(1)泥罐内的主要反应为:
i.ZnCO3(s) = ZnO(s) + CO2(g) H1
ii.CO2(g) + C(s) = 2CO(g) H 2
……
总反应:ZnCO3(s) + 2C(s) = Zn(g) + 3CO(g) H3
利用H1和H 2计算时H3,还需要利用_________反应的H。
(2)泥罐中,金属锌的状态变化是_____;d口出去的物质主要是_______。
Ⅱ.现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含铁等元素)、软锰矿(主要成分为MnO2,还含铁等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
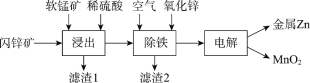
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,“催化”过程可表示为:
ⅰ:MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O
ⅱ:……
① 写出ⅱ的离子方程式:_________。
② 下列实验方案可证实上述“催化”过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b.________。
(4)除铁:已知①进入除铁工艺的溶液的pH约为3;②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。结合离子方程式说明,通入空气需同时补充适量ZnO的理由是_________。
(5)电解:用惰性电极电解时,阳极的电极反应是______。
(6)电解后的溶液中可循环利用的物质是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
(实验)在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
(数据)
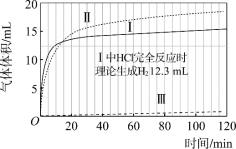
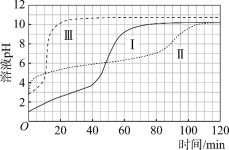
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是____。
(2)Ⅱ起始溶液中![]() 约为____。(选填“1”、“10”或“102”)
约为____。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是____。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:____。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a.实验Ⅴ起始速率 | b.实验Ⅱ起始速率 | c.实验ⅡpH=4.8时速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因:____。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②____。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解释其原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,
CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ 热量,写出该反应的热化学方程式:_________________________________
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
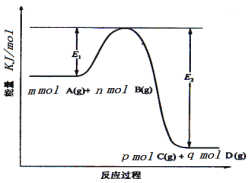
该反应△H =____kJ/mol(用含E1、E2式子表示); 在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:
CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K
H2 (g) +CO2 (g)平衡常数K
C(s) +CO2 (g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2
CO(g) +H2 (g)平衡常数K2
则K、K1 、K2之间的关系是 ___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下。
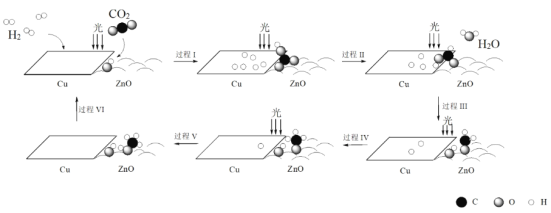
下列说法不正确的是
A.过程I中ZnO表面上进行CO2的吸附与转化
B.过程II中存在极性键的断裂与形成
C.过程V中生成CH3OH时吸收能量
D.总反应的化学方程式是CO2 + 3H2![]() CH3OH + H2O
CH3OH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com