
| A. | 86 | B. | 136 | C. | 50 | D. | 222 |
科目:高中化学 来源: 题型:解答题
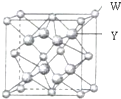 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
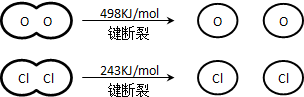
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
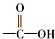 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CHBr=CHCH3 | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
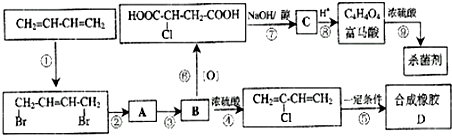

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
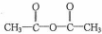 .
.
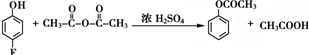 ;反应⑤的化学方程式为
;反应⑤的化学方程式为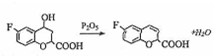 .
.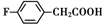 、
、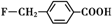 .
. 和乙酸酐为原料制备
和乙酸酐为原料制备 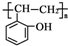 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com