
| A. | 与水相比,AgCl在Na2CO3溶液中的溶解度及溶度积均增大 | |
| B. | 反应后的溶液中:c(Na+)>c(CO32-)>c(Cl-)=c(Ag+)>c(OH-)>c(H+) | |
| C. | 溶液中c(Cl-)=2×10-5mol•L-1 | |
| D. | 沉淀转化反应;2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为2×10-9 |
分析 A.溶度积只与温度有关;
B.据Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,0.1mol•L-1Na2CO3溶液计算c(Cl-)=2×10-5mol/L,c (CO32-)=0.1mol/L;
C.由B分析判断;
D.据K=$\frac{[C{l}^{-}]^{2}}{[C{{O}_{3}}^{2-}]}$计算.
解答 解:A.溶度积只与温度有关,与水相比,AgCl在Na2CO3溶液中的溶度积不变,故A错误;
B.Ksp(Ag2CO3)=c(Ag+)2×0.1=1×10-11,c(Ag+)=10-5,Ksp(AgCl)=c(Cl-)×10-5=2×10-10,c(Cl-)=2×10-5mol/L,0.1mol•L-1Na2CO3溶液中c (CO32-)=0.1mol/L,所以c (CO32-)>c(Cl-),故B错误;
C.由B分析判断溶液中c(Cl-)=2×10-5mol/L,故C正确;
D.Ksp(Ag2CO3)=c(Ag+)2×0.1=1×10-11,c(Ag+)=10-5,Ksp(AgCl)=c(Cl-)×10-5=2×10-10,c(Cl-)=2×10-5mol/L,2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数:K=$\frac{[C{l}^{-}]^{2}}{[C{{O}_{3}}^{2-}]}$=$\frac{(2×1{0}^{-5})^{2}}{0.1}$=4×10-9,故D错误.
故选C.
点评 本题考查了沉淀的溶解平衡以及沉淀转化、溶度积的有关计算等,题目难度中等,注意把握溶度积的有关计算,侧重于考查学生的分析能力和计算能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
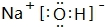 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
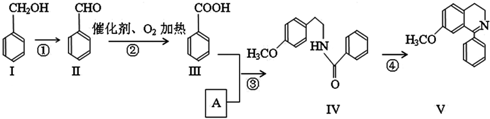
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2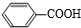
 +
+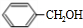 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com