
【题目】(1)已知下列热化学方程式:
H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1
H2(g)+1/2O2(g)==H2O(g) ΔH=241.8 kJ·mol1
C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1
C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1
回答下列问题:
①燃烧10gH2生成液态水,放出的热量为________。
②CO的燃烧热为________。
(2)0.3mol乙硼烷气体(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为________________________。
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出稀H2SO4溶液与稀NaOH溶液反应的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
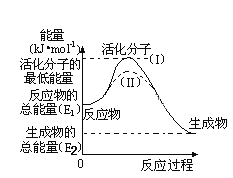
(5)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
①图中反应的ΔH=_____________kJ/mol(用含有E1、E2代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则H2O(g)=H2(g)+1/2O2(g)的活化能为________kJ/mol。
【答案】1429.0 kJ 283.0 kJ/mol B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol -(E1- E2)或(E2-E1) 409
【解析】
根据盖斯定律及热化学反应方程式的书写规则分析解答。
(1) ①10gH2的物质的量为5mol,根据已知条件可知,H2(g)+1/2O2(g)==H2O(l) ΔH=285.8 kJ·mol1,可知燃烧10gH2生成液态水,放出的热量为:285.8 kJ×5= 1429.0 kJ;故答案为:1429.0 kJ;
② a.C(s)+ 1/2O2(g)==CO(g) ΔH=110.5 kJ·mol1,b.C(s)+O2(g)==CO2(g) ΔH=393.5 kJ·mol1,![]() [b-2×a]得到,CO(g) + 1/2O2(g)= CO2(g) ΔH=283.0 kJ/mol;
[b-2×a]得到,CO(g) + 1/2O2(g)= CO2(g) ΔH=283.0 kJ/mol;
故答案为:283.0 kJ/mol;
(2) 0.3mol乙硼烷气体(B2H6)在氧气中燃烧,即B2H6(g)+O2(g)==B2O3(s)+H2O(l) △H= -649.5kJ×![]() =-2165 kJ/mol;
=-2165 kJ/mol;
故答案为:B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2 165 kJ·mol-1;
(4)根据已知条件,①2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1,②2NO(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol–1,②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1,
2NO2(g) ΔH=-113.0 kJ·mol–1,![]() (②-①)得到,NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=
(②-①)得到,NO2(g)+SO2(g)=SO3(g)+NO(g) ΔH=![]() -113.0-(-196.6)]= -41.8kJ/mol;
-113.0-(-196.6)]= -41.8kJ/mol;
故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol;
(5) ①从图中可知,反应物的总能量大于生成物总能量,该反应放热,即△H=-(E1-E2)kJ/mol;
故答案为:-(E1- E2)或(E2-E1);
②焓变=正反应的活化能-逆反应的活化能,可得到-241.8kJ/mol=167.2kJ/mol-逆反应的活化能,即逆反应的活化能为:241.8+167.2=409 kJ/mol;
故答案为:409。


科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
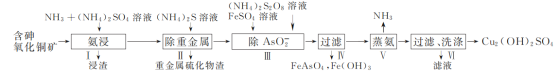
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
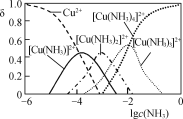
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。

试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
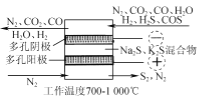
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
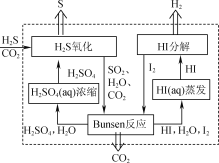
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴乙烷(CHBr2-CHBr2)是一种无色透明液体,密度2.967 g/mL,难溶于水,沸点244 ℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3As2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图所示。
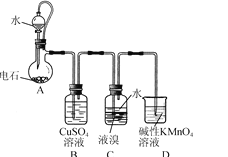
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+HC≡CH↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的措施是________。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为________(生成铜、硫酸和磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是________;装置C中反应已完成的现象是________;从装置C反应后的体系得到并纯化产品,需要进行的操作有________。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25 L含0.5 mol/LCa(OH)2的石灰乳,________,在100 ℃烘箱中烘干1 h。
已知:
① Ca10(PO4)6(OH)2中![]() 比理论值为1.67。影响产品
比理论值为1.67。影响产品![]() 比的主要因素有反应物投料比及反应液pH。
比的主要因素有反应物投料比及反应液pH。
②在95 ℃,pH对![]() 比的影响如图所示。
比的影响如图所示。
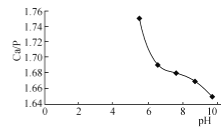
③实验中须使用的试剂:含0.5mol/LCa(OH)2的石灰乳、0.3mol/L磷酸及蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如下图所示,其中M、N为厌氧微生物电极。
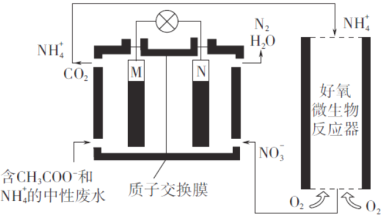
下列有关叙述错误的是
A. 负极的电极反应为CH3COO-—8e-+2H2O==2CO2↑+7H+
B. 电池工作时,H+由M极移向N极
C. 相同条件下,M、N两极生成的CO2和N2的体积之比为3:2
D. 好氧微生物反应器中发生的反应为NH3+2O2==NO3-+2H++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是

A. 石墨电极与直流电源负极相连
B. 铜电极的反应式为:2H2O+2e-![]() 2OH-+H2↑
2OH-+H2↑
C. 氢氧化钠在石墨电极附近产生, Na+ 向石墨电极迁移
D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
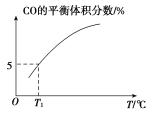
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com