
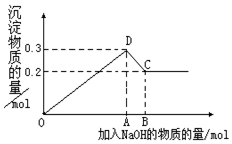
 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:分析 AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,OD段发生的离子反应有Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓、继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,DC段发生的离子反应Al(OH)3+OH-═AlO2-+2H2O,此时沉淀为氢氧化镁0.2mol,溶液为NaCl、NaAlO2溶液.结合图象与反应的对应关系、沉淀的物质的量及原子守恒来计算.
解答 解:(1)由图象可知,0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,A~B发生Al(OH)3+OH-═AlO2-+2H2O,
C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,
故答案为:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)DC段发生的离子反应Al(OH)3+OH-═AlO2-+2H2O,此时沉淀为氢氧化镁0.2mol,则Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,
由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,
所以原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1,
故答案为:2:1;
(3)由Mg2++2OH-═Mg(OH)2↓
0.2mol 0.4mol
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
则C点NaOH的物质的量为0.4mol+0.3mol+0.1mol=0.8mol,此时铝离子完全转化为AlO2-,镁离子完全转化为沉淀,
故答案为:0.8;AlO2-;
(4)0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,
A~B发生Al(OH)3+OH-═AlO2-+2H2O,
则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,
线段AB对应的NaOH的物质的量为0.1mol,
所以线段OA:AB=0.7mol:0.1mol=7:1,
故答案为:7:1.
点评 本题考查学生利用离子反应及金属与金属的化合物的性质来计算,明确图象中每段发生的化学反应是解答本题的关键,并注意利用原子守恒的方法来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H1 | B. | 2CO(g)+O2(g)═2CO2(g)△H2 | ||
| C. | S(s)+$\frac{3}{2}$O2(g)═SO3(s)△H3 | D. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 某单质之一是空气中主要成分,最常见的助燃剂 |
| Y | 其某种核素不含中子 |
| Z | 失去一个电子后,形成Ne原子电子层结构 |
| W | 最外层电子数是次外层电子数的2倍 |
 、
、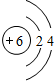 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点、沸点:Li>Na>K>Rb>Cs | B. | 密度:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li>Na>K>Rb>Cs | D. | 还原性:Li>Na>K>Rb>Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
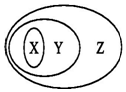 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 置换反应 | 氧化还原反应 | 化学反应 |
| C | 非金属氧化物 | 酸性氧化物 | 氧化物 |
| D | 金属 | 单质 | 纯净物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com