
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
【答案】1s22s22p63s23p2 CO CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力 ![]() 非极性键 N2分子中的共价三键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
非极性键 N2分子中的共价三键键能很大,共价键很牢固 H—C≡C—H 3 2 > 形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强
【解析】
由题意知,a是单原子分子,含14个电子,是Si,Si可作半导体材料;b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价三键键能很大,所以N2分子很稳定;d是四核化合物,即4个原子共有14个电子,只能是烃,故d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键,据以上分析解答。
由题意知,a是单原子分子,含14个电子,是Si,Si可作半导体材料;b是两个原子的化合物,根据其物理性质:无色无味气体,推断b为CO,CO一旦进入肺里,会与血液中的血红蛋白结合而使血红蛋白丧失输送氧气的能力,使人中毒;c是双原子单质,每个原子有7个电子,故c为N2,N2分子的结构式为N≡N,为非极性键,N2分子中的共价三键键能很大,所以N2分子很稳定;d是四核化合物,即4个原子共有14个电子,只能是烃,故d为C2H2,C2H2的结构式为H—C≡C—H,有两个H—C σ键,一个C—C σ键,两个π键,
(1)由以上分析可知,a为Si,核电荷数为14,原子核外电子排布式为1s22s22p63s23p2 ;综上所述,本题答案是:1s22s22p63s23p2。
(2) 由以上分析可知,b是CO,CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力,所以人一旦吸入CO气体后就易引起中毒;综上所述,本题答案是:CO,CO一旦被吸入肺里后,会与血液中的血红蛋白结合,使血红蛋白丧失输送氧气的能力。
(3) 由以上分析可知,c为N2,其电子式![]() ;分子中所含非极性键;由于N2分子中的共价三键键能很大,共价键很牢固,所以氮气单质常温下性质稳定,不易起反应;综上所述,本题答案是:
;分子中所含非极性键;由于N2分子中的共价三键键能很大,共价键很牢固,所以氮气单质常温下性质稳定,不易起反应;综上所述,本题答案是:![]() ,非极性键,N2分子中的共价三键键能很大,共价键很牢固。
,非极性键,N2分子中的共价三键键能很大,共价键很牢固。
(4) 由以上分析可知,d为C2H2,其结构式为H—C≡C—H;分子内所含共价键有3个σ键,2个π键;由于形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强,所以σ键与π键的强度:σ>π;
综上所述,本题答案是:H—C≡C—H;3,2 ,>,形成σ键的原子轨道的重叠程度比π键的重叠程度大,形成的共价键强。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是

A. 常温下K(HX)≈1×10-12
B. a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C. c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D. 相同条件下,X-的水解能力弱于HX的电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5mol NaOH所含Na+数目相等。
(5)12.4g Na2R含0.4mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3高,原因是________________________________________________。
(2)Na3AsO4 中含有的化学键类型包括________________________;AsO43-的空间构型为____________(用文字描述)。
(3)NH3和F2在Cu催化下可发生反应4NH3+3F2=NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____________________(填序号)。写出基态铜原子的价电子排布式_______________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图1所示。则M元素位于周期表的第_____族。
(2)图2是研究部分主族元素氢化物的沸点变化规律的图象,折线c可以表达出第_____族元素气态氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线(a和b),你认为正确的是折线_____(填a或b)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
CO2(g)+H2(g)达到平衡状态,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
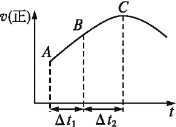
A.反应物浓度:A点小于C点
B.该反应的正反应为吸热反应
C.C点时反应进行的程度最大
D.Δt1=Δt2时,生成H2的物质的量:AB段小于BC段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以方潜矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示:

部分化合物的Ksp如下表所示:
物质 | PbCl2 | PbS | PbCrO4 |
Ksp | 1.2×10-5 | 9.0×10-29 | 1.8×10-14 |
请回答下列问题:
(1)“焙烧”生成的气体可用于工业制备____________。
(2)写出“高温还原”的主要化学方程式:____________。
(3)“粗铅”的杂质主要有锌,铁,铜,银等,电解精炼时阴极反应式为____________。阳极泥的主要成分为____________。
(4)铅与稀盐酸反应产生少量气泡后反应终止,原因是____________。写出制备PbO2的离子方程式:____________。
(5)Pb(NO3)2是强酸弱碱盐,氢硫酸(H2S)是弱酸,向Pb(NO3)2溶液中通入H2S气体是否能产生黑色PbS沉淀____________?(列式计算说明,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15)。
(6)将PbCrO4加入足量硝酸中,部分振荡,观察到主要现象是____________,反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com