

分析 (1)过氧化钠具有强氧化性,可能与亚硫酸钠反应生成硫酸钠;
(2)根据仪器构造可知,盛放亚硫酸钠的仪器为三颈烧瓶;亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水;由于氧气能够氧化亚硫酸钠,干扰该实验,所以通入氮气排除装置中空气;
(3)①二氧化硫的密度大于空气,收集二氧化硫时需要采用长进短出的方式;
②由于水能够与过氧化钠反应,所以装置B用于干燥二氧化硫,可以盛放无水氯化钙或五氧化二磷;二氧化硫有毒,多余的气体需要吸收;
(4)假设通过(3)中的操作证明发生了b反应,需要先将过氧化钠完全消耗掉,此时淡黄色固体变成无色,然后通过检验固体含有硫酸根离子证明反应生成了硫酸钠.
解答 解:(1)类比过氧化钠与二氧化碳的反应可知,过氧化钠与二氧化硫的反应为:2Na2O2+2SO2═2Na2SO3+O2(记为a),由于亚硫酸钠容易被氧化,而过氧化钠具有强氧化性,则二者也可能发生反应:Na2O2+SO2═Na2SO4,
故答案为:Na2O2+SO2═Na2SO4;
(2)根据图示仪器构造可知,盛放Na2SO3的仪器名称为三颈烧瓶;亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;由于氧气能够氧化亚硫酸钠,干扰该实验,所以通入氮气排除装置内空气,防止其产生干扰,
故答案为:三颈烧瓶;Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;排除装置内空气,防止其产生干扰;
(3)①由于二氧化硫的密度大于空气,所以收集二氧化硫时采用长导管进、短导管出的方式,补充完整后的装置图为: ,
,
故答案为: ;
;
②A产生的气体中混有水,而水能够与过氧化钠反应生成氧气,干扰实验检验,所以装置B的目的是干燥二氧化硫,可以盛放无水氯化钙或五氧化二磷;二氧化硫是一种有毒气体,多余的气体需要吸收,所以在C、D之间添加一个吸收没有反应的二氧化硫的装置,
故答案为:无水氯化钙或五氧化二磷;吸收没有反应的二氧化硫;
(4)假设通过(3)中的操作证明反应a发生了,为确定反应b也发生了,实验中应持续通入气体至C中过氧化钠完全反应,此时淡黄色固体的颜色消失;
然后将反应后的固体溶于蒸馏水,加入足量的盐酸,将亚硫酸钠完全除掉,再加入适量的硫酸钡溶液,得到白色沉淀,证明固体中含有硫酸根离子,从而证明反应b也发生了,
故答案为:固体淡黄色完全消失;溶于蒸馏水,然后加入足量的盐酸,再加入适量的氯化钡溶液,得到白色沉淀.
点评 本题考查了性质实验方案设计,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握常见物质的性质及检验方法,明确性质实验方案设计与评价原则.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 最外层电子数为8的粒子是稀有气体元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
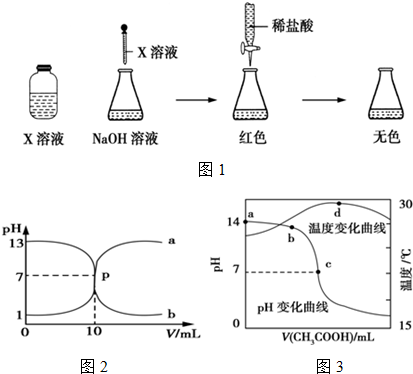
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
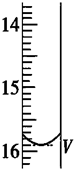 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-x)n | B. | W(m-x-n)n | C. | $\frac{W}{m}$(m-x+n) | D. | $\frac{m-x+n}{mW}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl2═CH2 | B. | CH3-CH═CH2 | C. | CH3-CH═CH-CH3 | D. | CH2═CH-CH2-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com