
(12分)【有机化学基础】
用甲苯生产一种常用的化妆品防霉剂,其生产过程如图(反应条件没有全部注明).

根据转化图填空
(1)有机物A的结构简式_____________
(2)在合成路线中,设计第③步反应的目的是:__________________________.
(3)写出反应⑤的化学方程式__________________________________________.
(4)请写出由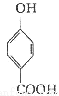 生成C7H5O3Na的化学反应方程式______________________________.
生成C7H5O3Na的化学反应方程式______________________________.
(5)下列有关说法正确的是_____________。

A.莽草酸、对羟基苯甲酸都属于芳香族化合物
b.1 mol莽草酸与NaOH溶液反应,最多消耗4 molNaOH
c.二者均可以发生酯化、氧化、加成等反应
d.利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
(6)写出同时符合下列要求的 所有同分异构体的结构简式_____________.
所有同分异构体的结构简式_____________.
A.含苯环
b.可与FeCl3溶液发生显色反应
c.一氯代物有两种
d.能发生银镜反应,不能发生水解反应。
(1) (2)保护酚羟基,防止其被氧化
(2)保护酚羟基,防止其被氧化
(3)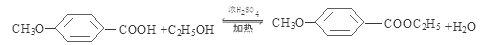
(4)
(5)cd;(6)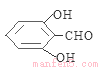 、
、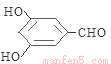 。
。
【解析】
试题分析:(1)甲苯与氯气在催化剂作用下发生对位的取代反应产生对氯甲苯,所以有机物A的结构简式是 ;
; 与NaOH的水溶液发生取代反应产生
与NaOH的水溶液发生取代反应产生 ;(2)
;(2) 与CH3I发生取代反应产生
与CH3I发生取代反应产生 ;设计该步反应的目的是保护酚羟基,防止其被氧化;
;设计该步反应的目的是保护酚羟基,防止其被氧化; 在酸性条件下被KMnO4溶液氧化为
在酸性条件下被KMnO4溶液氧化为 ,(3)该物质也乙醇在浓硫酸作用下发生酯化反应形成酯B:
,(3)该物质也乙醇在浓硫酸作用下发生酯化反应形成酯B: 和水;反应⑤的化学方程式是
和水;反应⑤的化学方程式是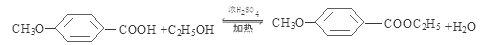 ;B与HI发生取代反应形成
;B与HI发生取代反应形成 ;(4)
;(4) 有酸性,可以与NaHCO3发生反应形成生成分子式是C7H5O3Na
有酸性,可以与NaHCO3发生反应形成生成分子式是C7H5O3Na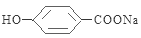 该反应的化学反应方程式是
该反应的化学反应方程式是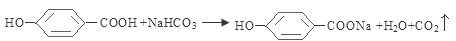 ;(5) A.莽草酸不含有苯环,对羟基苯甲酸含有苯环,因此不都属于芳香族化合物,错误;b.由于莽草酸分子中含有羧基可以与NaOH发生反应,而醇羟基不能与NaOH反应,所以1 mol莽草酸与NaOH溶液反应,最多消耗1 molNaOH;c.二者均含有羧基,可以发生取代反应,含有醇羟基和酚羟基,可以发生氧化反应,前者含有碳碳双键,后者含有苯环,因此都可以发生加成反应,正确;d.后者含有酚羟基,前者没有,因此可以利用FeCl3溶液可区别莽草酸和对羟基苯甲酸,正确;选项是cd;(6)
;(5) A.莽草酸不含有苯环,对羟基苯甲酸含有苯环,因此不都属于芳香族化合物,错误;b.由于莽草酸分子中含有羧基可以与NaOH发生反应,而醇羟基不能与NaOH反应,所以1 mol莽草酸与NaOH溶液反应,最多消耗1 molNaOH;c.二者均含有羧基,可以发生取代反应,含有醇羟基和酚羟基,可以发生氧化反应,前者含有碳碳双键,后者含有苯环,因此都可以发生加成反应,正确;d.后者含有酚羟基,前者没有,因此可以利用FeCl3溶液可区别莽草酸和对羟基苯甲酸,正确;选项是cd;(6) 
同时符合条件A.含苯环b.可与FeCl3溶液发生显色反应,说明含有酚羟基;c.一氯代物有两种分子则苯环上含有2种不同的氢原子;d.能发生银镜反应,不能发生水解反应含有醛基,但是不是甲酸形成的酯中的醛基, 的所有同分异构体是
的所有同分异构体是 、
、 。
。
考点:考查有机物的结构、性质、转化、物质的反应类型、化学方程式和同分异构体的书写的知识。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:2014-2015江苏省泰州市姜堰区高一上学期期末化学试卷(解析版) 题型:选择题
下列有关物质检验的实验结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | Fe粉与水蒸气加热,产生气体通入肥皂水冒泡 | 反应生成H2 |
B | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 溶液中一定含有SO42- |
C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
D | 将某未知溶液作焰色反应来鉴定所含金属元素,肉眼直接观察到黄色火焰 | 溶液中含钠元素,但不能确定是否含钾元素 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.在一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示.图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段为使用催化剂;图甲中t0~t1阶段c(B)未画出。

下列说法不正确的是
A.该反应为吸热反应 B.B在t0~t1阶段的转化率为60%
C.t4~t5阶段改变的条件为减小压强 D.此温度下该反应的化学平衡常数K=9/8
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下列推断正确的是
A.SiO2是酸性氧化物,但能与NaOH溶液反应也能与HF溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA。
B.标准状况下,0.1 mol Cl2溶于水,转移电子的数目为0.1 NA。
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。其电路工作原理如图所示。下列说法中正确的是

A.电池充电时,OH-由甲侧向乙侧移动
B.甲放电时为正极,充电时为阳极
C.放电时正极的电极反应式为MHn—ne-=M+nH+
D.汽车下坡时发生图中实线所示的过程
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.放热反应的反应速率一定大于吸热反应的反应速率
B.熔融状态下能导电的化合物一定含离子键
C.增大反应物浓度可加快反应速率,因此可用浓硫酸与 铁反应增大生成氢气的速率
铁反应增大生成氢气的速率
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C.恒温下,体积可变的密闭容器中发生反应2NO2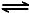 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大
N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大
D.25℃时,将NH3H2O稀溶液加水稀释,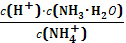 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(15分)海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。
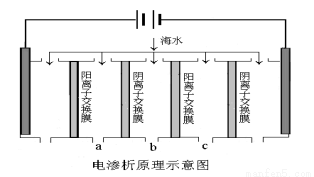
① 开始时阳极的电极反应式为 。
② 电解一段时间, 极(填“阴”或“阳”)会产生水垢,其成份为 (填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:
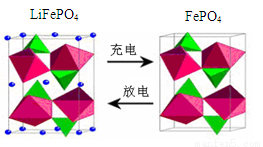
该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示 (填粒子符号),充电时该电极反应式为 。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为 (空气中氧气的体积分数按20%计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com