
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是________和________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
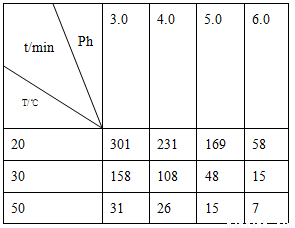
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0
c.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。

(1)I2 O2
(2)①OH- ②1.00×10-4 ③b、a、c
(3)①A 2H++2e-=H2↑
②O2+4H++4e-=2H2O ③(x-2y)/y
【解析】本题以臭氧为载体考查了化学反应速率、电化学等化学反应原理,同时考查了考生对图表的观察分析能力。
(1)臭氧具有氧化性,能与碘化钾发生氧化还原反应生成氧气、碘单质和氢氧化钾。
(2)30℃、pH=4.0时,臭氧分解一半所用时间为108 min,反应速率v=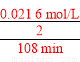 =1.00×10-4mol/(L·min);结合表中数据知反应速率在b条件下最小、c条件下最大。
=1.00×10-4mol/(L·min);结合表中数据知反应速率在b条件下最小、c条件下最大。
(3)观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O2+4H++4e-=2H2O;设y L混合气体中臭氧的体积分数为a,由电子守恒有2x=y a×6+y(1-a)×4,解得a=(x-2y)/y。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。
A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16 g 14CH4所含中子数目为8NA
C.常温常压下,7.1 g Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
D.标准状况下,22.4 L空气含有NA个单质分子
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
下列各组离子在强碱性溶液中,可以大量共存的是( )
A.K+、Na+、HSO 、Cl-
、Cl-
B.Na+、Ba2+、[Al(OH)4]-、NO
C.NH 、K+、Cl-、NO
、K+、Cl-、NO
D.Fe2+、Na+、ClO-、S2-
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
[双选题]烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的
CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
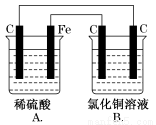
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
已知2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
[双选题]在25℃某稀溶液中,由水电离产生的c(H+)=10-13 mol·L-1,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液的pH可能约为1
D.该溶液的pH可能约为13
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
已知反应
PCl5(g)  PCl3(g)+Cl2(g)①
PCl3(g)+Cl2(g)①
2HI(g)  H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g) N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变
B.均增大
C.①增大,②不变,③减少
D.①减少,②不变,③增大
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:填空题
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com