
| 选项 | 条件 | 结论 |
| A | 若X原子半径X>Y | 原子序数:X<Y |
| B | 若最高价氧化物对应水化物酸性X>Y | 元素的电负性:X>Y |
| C | 若价电子数X>Y | 最高正价:X>Y |
| D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、同主族,原子序数越大,半径越大;
B、元素的非金属性越强,其最高价氧化物对应水化物的酸性越强;
C、需考虑特殊情况,O与F无最高正价;
D、H原子最外层电子数是1,一般形成共价化合物.
解答 解:A、若XY处于同一主族,X原子半径X>Y,那么X的原子序数>Y,故A错误;
B、最高价氧化物对应水化物酸性X>Y,那么非金属性X>Y,即电负性X>Y,故B正确;
C、若价电子数X>Y,比如O>N,但是最高正价N>O,故C错误;
D、H原子最外层电子数是1,一般形成共价化合物,故D错误,
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、性质及同周期和同主族性质变化规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | C(石墨)=C(金刚石)△H>0,则石墨比金刚石稳定 | |
| C. | H2(g)+F2(g)=2HF(g);△H1=-270kJ/mol,则1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 | |
| D. | S(s)+O2(g)=SO2(g);△H1,S(g)+O2(g)=SO2(g);△H2,△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
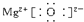 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
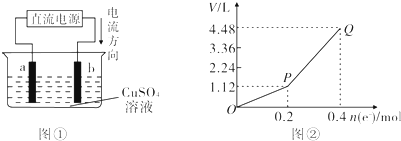
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com