
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
分析 A.根据原子由基态转化成激发态,电子能量增大,需要吸收能量;
B.根据电子排布式的书写方法来解答;
C.S电子云轮廓图都是球形,但能层越大,球的半径越大;
D.根据主族元素的周期序数=电子层数;最外层电子=主族序数;最后一个电子排在哪个轨道就属于哪个区.
解答 解:A.基态Mg的电子排布式为1s22s22p63s2,能量处于最低状态,当变为1s22s22p63p2时,电子发生跃迁,需要吸收能量,变为激发态,故A错误;
B.24Cr原子的电子排布式是:1s22s22p63s23p63d54s1,半充满轨道能量较低,故B错误;
C.所有原子任一能层的S电子云轮廓图都是球形,能层越大,球的半径越大,故C正确;
D.价电子排布为5s25p1的元素最外层电子数为3,电子层数是5,最后一个电子排在P轨道,所以该元素位于第五周期第ⅢA族,是P区元素,故D错误;
故选:C.
点评 本题主要考查了电子排布式的运用以及轨道形状,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )
常温下,向20mL 0.2mol.L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中1代表H2A,II代表HA-,III代表A2-).根据图示判断,下列说法正确的( )| A. | 欲使NaHA溶液里中性,可以向其中加入酸或碱 | |
| B. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,b极发生还原反应 | |
| B. | 每生成1molO2,有44gCO2被还原 | |
| C. | 该装置工作时,H+从a极区通过质子交换膜向b极区迁移 | |
| D. | a电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
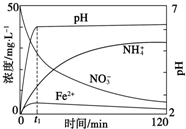 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中的7 个基本物理量之一 | |
| B. | 硫酸的摩尔质量是98 g | |
| C. | 0.5molH2 约含有3.01×1023个氢原子 | |
| D. | NA个氧气分子与NA 个氢气分子的质量比为16:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子 | |
| B. | 1mol Fe参与反应失去电子数目一定为2NA | |
| C. | 金属钠和氧气反应制取过氧化钠,每生成1mol过氧化钠,转移电子数为4NA | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com