
| A. | 热稳定性:H2O>H2S>HF | |
| B. | 微粒X2-和Y2+的核外电子排布相同,离子半径:X2-<Y2+ | |
| C. | 第3周期金属都能与氯气发生化合反应 | |
| D. | 第IVA族元素的氧化物都能与NaOH溶液反应生成盐和水 |
分析 A.非金属性越强,气态氢化物越稳定;
B.核外电子排布相同的离子,原子序数越大,半径越小;
C.第3周期金属包括Na、Mg、Al;
D.CO属于不成盐氧化物.
解答 解:A.非金属性越强,气态氢化物越稳定,非金属性:F>O>S,则热稳定性:HF>H2O>H2S,故A错误;
B.核外电子排布相同的离子,原子序数越大,半径越小,微粒X2-和Y2+的核外电子排布相同,则原子序数Y>X,所以离子半径:X2->Y2+,故B错误;
C.第3周期金属包括Na、Mg、Al,Na、Mg、Al均能与氯气发生化合反应生成氯化物,故C正确;
D.第IVA族元素的氧化物中的CO属于不成盐氧化物,与氢氧化钠溶液不反应,故D错误.
故选C.
点评 本题考查了非金属性半径、离子半径半径、金属与非金属元素之间的反应、第IVA族元素的氧化物,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
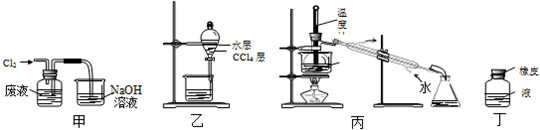
| A. | 用装置甲氧化废液中的溴化氢 | B. | 用装置乙分离CCl4层和水层 | ||
| C. | 用装置丙分离CCl4和液溴 | D. | 用仪器丁长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下遇碘水均会变蓝色 | |
| B. | 一定条件下,它们都能发生水解反应 | |
| C. | 它们的组成都含有C、H、O、N等元素 | |
| D. | 油脂都是高级脂肪酸的甘油酯,是高热营养素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 负极发生还原反应 | B. | 正极反应为 Cu-2e-═Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3 COOH)=K(NH3•H2 O) | |
| D. | 该溶液中c(CH3 COO-)大于同浓度CH3 COONa溶液中的c(CH3 COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl 溶液、④(NH4)2Fe(SO4)2溶液中,c(${NH}_{4}^{+}$)的大小关系:④>①>②>③ | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(${HCO}_{3}^{-}$)+c(${CO}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.
钛、铜可以作为多种催化剂的主体.如以TiO2覆盖在Cu2Al2O4表面作催化剂,可以将CO2与CH4直接转化成乙酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com