
| A. | 该气体的物质的量为m/M mol | |
| B. | 该气体在标准状况下的体积为22.4m/M L | |
| C. | 该气体中所含的原子总数为mNA/M个 | |
| D. | 该气体溶于1L水中(不考虑发生反应),所得溶液的物质的量浓度为m/M mol•L-1 |
分析 结合n=$\frac{m}{M}$、V=nVm、c=$\frac{n}{V}$、N=nNA及分子构成计算.
解答 解:A.mg某气体,它的摩尔质量为Mg•mol-1,则物质的量为$\frac{m}{M}$mol,故A正确;
B.该气体在标准状况下的体积为$\frac{m}{M}mol×22.4L/mol$=$\frac{22.4m}{M}$L,故B正确;
C.它由双原子分子构成,所含的原子总数为为$\frac{m}{M}$mol×2×NA=$\frac{2m{N}_{A}}{M}$个,故C错误;
D.溶于1L水中,溶液的体积未知,不能计算物质的量浓度,故D错误;
故选AB.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取5.80 mL 乙醇溶液 | |
| B. | 乙酸的酯化反应实验中用NaOH溶液除去生成物中的乙酸 | |
| C. | 用溴水可以除去乙烷中的乙烯 | |
| D. | 食盐可以鉴别白酒和食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 每生成1mol的NaClO3转移10mol的电子 | |
| C. | Cl2既是氧化剂又是还原剂 | |
| D. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 1 mol乙醇被氧化转移6 mol电子 | |
| C. | 在外电路中电子由负极沿导线流向正极 | |
| D. | 电池正极得电子的物质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )
我国首创的海洋电池以铝板、铂网为电极,以海水作为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列有关该电池说法正确的是( )| A. | 该电池工作时将电能转化为化学能 | |
| B. | 通常一段时间后该电池只需更换铝板就可继续使用 | |
| C. | 负极反应式是:O2+2H2O+4e-=4OH- | |
| D. | 铝片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
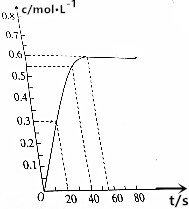 298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.
298K时,在2L的恒容密闭容器中,发生可逆反应:2NO2(g)?N2O4(g).N2O4的物质的量浓度随时间的变化如图.达到平衡时N2O4的浓度为NO2的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com