
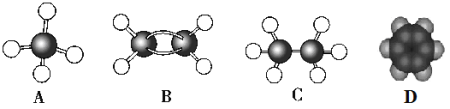
【题目】现有A、B、C、D四种烃,其球棍模型或比例模型如图:
(1)可以用来鉴别A和B的试剂是__________
A、水B、稀硫酸C、溴的四氯化碳溶液D、酸性高锰酸钾溶液
(2)上述四种物质互为同系物的是__________。(填字母)
(3)在一定条件下,B能发生聚合反应,写出该反应的方程式__________。
(4)上述四种物质中有一种可以在一定条件下与浓硝酸反应,请写出反应的化学方程式:__________
(5)E是一种新合成的烃,其碳架呈三棱柱体(如图所示);
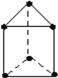
①上述物质中与E互为同分异构体的是__________。(填分子式)
②E的二氯取代物有__________种。
【答案】CD AC ![]()
 C6H6 3
C6H6 3
【解析】
由题干中提供的球棍模型和比例模型可知,A为甲烷,B为乙烯,C为乙烷,D为苯。
(1)乙烯能够与溴的四氯化碳溶液反应使其褪色,而甲烷不与其反应;乙烯也能使高锰酸钾溶液褪色,而甲烷不行;所以鉴别甲烷和乙烯用C和D;
(2)上述四种物质互为同系物的是甲烷和乙烷,即A和C;
(3)乙烯能发生加聚反应生成聚乙烯;
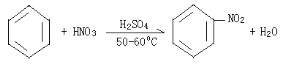
(4)苯可以与浓硝酸在浓硫酸存在的条件下,水浴加热50至60℃时发生硝化反应,生成产物硝基苯;
(5)①由E的结构可知,其分子式为C6H6,与苯互为同分异构体;
②两个氯原子在取代H时,可以取代三角形底面的两个H,也可以取代长方形长边相邻的两个H,还可以取代长方形对角线上的两个H,共计三种。


科目:高中化学 来源: 题型:
【题目】聚酯纤维(Polyesterfiber),俗称“涤纶”,是由有机二元酸和二元醇缩聚而成的聚酯经纺丝所得的合成纤维,属于高分子化合物。以1,3—丁二烯为原料合成PBT纤维的一种合成路线如下:
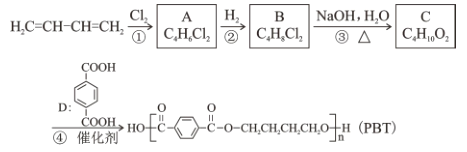
回答以下问题:
(1)A 的官能团有____(填名称), C 的系统命名为_____。
(2)①的反应类型是____。
(3)1,3—丁二烯分子中最多有___个原子共面;1,3—丁二烯与苯乙烯发生1:1 加聚可合成丁苯橡胶,丁苯橡胶的结构简式为___。
(4)反应③的化学方程式为_____;反应④的化学方程式为_____。
(5)物质D有多种同分异构体,符合以下条件的共有____种。
①能发生水解反应② 遇饱和 FeCl3 溶液显色③1 mol 该同分异构体能与足量银氨溶液反应生成 4mo1 Ag
(6)结合上述流程中的信息,设计由乙烯和对苯二甲酸为起始原料制备聚对苯二甲酸乙二醇酯纤维 ( PET ) 的合成路线(无机试剂任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,应选用的容量瓶规格是_____________(填序号)。
A.25mLB.50mLC.100mLD.250mL
(2)经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的_____________(填序号)。
A.5mLB.10mLC.25mLD.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是_____________
A.①②③④B.③④①②C.④①②③D.③①④②
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的二氧化锰和含有4 mol氯化氢的浓盐酸充分反应制氯气,下列说法正确的是( )
A.该实验中共消耗1 mol 二氧化锰,生成1 mol氯气
B.为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
D.氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
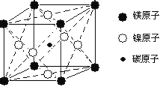
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。
(1)该新型超导晶体的一个晶胞如图所示,则该晶体的化学式是__________。镍在元素周期表中的位置是______,Ni2+的价电子有_________种不同运动状态。
(2)500-600℃时,BeCl2以双聚分子存在的BeCl2的结构式为________________________。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于______晶体,配体是______该配合物中存在的作用力类型有___________(填标号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
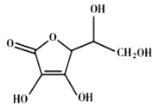
(4)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_______;推测抗坏血酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
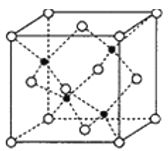
(5)副族元素Zn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中为( ![]() 为Se,
为Se,![]() 为Zn),Zn的配位数为______,该晶体的密度为
为Zn),Zn的配位数为______,该晶体的密度为![]() g/cm3,则Zn—Se键的键长为______nm。
g/cm3,则Zn—Se键的键长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.自来水中通入少量Cl2用于杀菌、消毒是利用了Cl2能杀菌、消毒
B.漂白粉的主要成分是Ca(ClO)2,可用于杀菌、消毒
C.漂白粉是由Cl2和NaOH浓溶液制得
D.漂白粉与空气中的CO2和H2O反应而失效,因此要密封保存在干燥阴凉处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是
A.不考虑空间异构,C2H6O的一氯代物有3种结构
B.分子式符合C5H11Cl的化合物有6种
C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目多于3种
D.菲的结构简式为![]() ,它与硝酸反应可生成6种一硝基取代物
,它与硝酸反应可生成6种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol氯气通入水中,转移电子的数目为0.1NA
B.常温常压下,7.8 g过氧化钠中含有阴离子的数目为0.2NA
C.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
D.标准状况下,22.4L C12与足量的铁充分反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质都是人体必需的营养物质.请回答:
(1)向蛋白质溶液中加入饱和(NH4)2SO4溶液可使蛋白质 (填“盐析”或“变性”).
(2)油脂被摄入人体后,在酶的作用下水解生成 (写名称).
(3)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是 和 (写名称).氨基酸 (填“能”或“不能”)与盐酸反应.
(4)葡萄糖是一种重要的 (填“单”“二”或“多”)糖,部分葡萄糖在体内被氧化生成二氧化碳和水,同时 (填“放出”或“吸收”)能量.写出葡萄糖在体内被氧化的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com