
【题目】铅蓄电池的两极分别为Pb和PbO2,电解质溶液为硫酸,工作时反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是( )
A. Pb为正极,发生氧化反应 B. 外电路电流由PbO2流向Pb
C. SO42-只向正极移动 D. 溶液的c(H+)不断增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知298K时,2SO2(g)+O2(g)![]() 2SO3(g);△H =-197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量为Q2。则下列关系正确的是
2SO3(g);△H =-197kJ·mol-1。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1;向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量为Q2。则下列关系正确的是
A、Q2<Q1< 197kJ B、Q2=Q1=197kJ
C、Q2<Q1=197kJ D、Q1=Q2<197kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于组成细胞的元素组成叙述正确的是( )
A. C元素因其在细胞的干重中含量最高,所以C是生命的最基本元素
B. C原子构成的碳链是生物大分子的骨架
C. C、H、O、N是蛋白质和糖类中共有的4种元素
D. 构成细胞的微量元素就是指细胞中含量很少且可有可无的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
A、x+y<n B、该化学平衡向右移动
C、B的转化率增大 D、C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.反应2CO(g)=2C(s)+O2(g) △H>0可以自发进行
B.放热反应在常温条件下一定很容易进行
C.平衡常数发生变化,化学平衡一定发生移动
D.化学平衡发生移动,平衡常数一定发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮和碳的化合物与人类生产、生活密切相关。已知:
N2(g)+O2(g)===2NO(g);ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH= 。
(2)在压强为0.1 MPa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g);ΔH<0。
CH3OH(g);ΔH<0。
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增大甲醇产率的是 (填字母)。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)如图所示的装置能吸收和转化NO2和SO2。
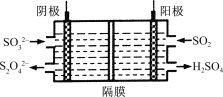
阳极区的电极反应式为 。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式: 。
可在阴极区再生。写出该反应的离子方程式: 。
(4)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
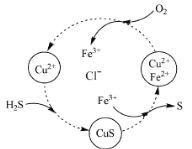
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
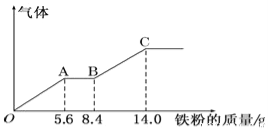
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com