
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)] 时,请用下图所列仪器设计一个简单的实验方案。
(2)①请写出用下图装置制备氨气的化学反应方程式___________________。
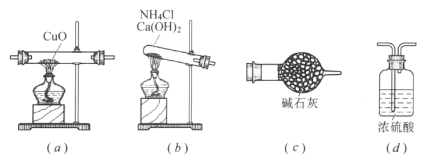
②仪器连接的顺序为(用字母编号表示,仪器可重复使用) ______________________,(d)中浓硫酸的作用是___________,实验完毕时观察到(a)中的现象是______________________。
③列出计算Cu的相对原子质量的表达式:______________________。
(2)有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。
①若CuO未完全分解,则所测定的Cu的相对原子质量会______________(偏大或偏小)。
②请设计一个简单的实验检验该红色物质中是否含有Cu2O________________。
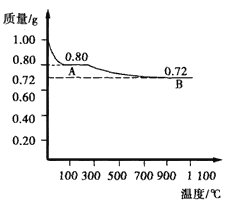
(3)在解决了问题(2)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取0.98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末B。如下图所示:
据此可推得A为__________,且AB段发生的反应为_________________,
由此得到的热稳定性的结论是____________________。
【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2 +2NH3
CaCl2 +2NH3![]() + 2H2O bcacd 吸收未反应的氨气;防止空气中水分进入 固体由黑色转变为红色
+ 2H2O bcacd 吸收未反应的氨气;防止空气中水分进入 固体由黑色转变为红色 ![]() -16 偏大 取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O CuO 4CuO
-16 偏大 取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O CuO 4CuO![]() 2Cu2O+O2
2Cu2O+O2![]() CuO热稳定性不如Cu2O
CuO热稳定性不如Cu2O
【解析】
(1)①NH4Cl与Ca(OH)2混合加热,发生复分解反应产生NH3,据此书写方程式;
②根据题给要求要测量氧化铜和水的质量,考虑到氨气可以和浓硫酸反应,但是不和碱石灰反应,所以应该用碱石灰来吸收NH3中的水蒸气,而用浓硫酸来吸收氨气,同时要注意防止空气中的水对实验的干扰,根据CuO及反应产生的Cu的颜色变化分析实验现象;
③根据水和氧化铜的质量结合化学方程式2NH3+3CuO![]() N2+3Cu+3H2O进行计算,即可求出铜的相对原子质量;
N2+3Cu+3H2O进行计算,即可求出铜的相对原子质量;
(2)①根据(1)中③计算的结果,分析实验误差;
②根据Cu2O与酸混合发生歧化反应分析判断;
(3)先计算0.98 g Cu(OH)2固体的物质的量,利用Cu元素守恒,结合80℃~100℃时,得到黑色固体粉末的质量确定物质成分,再根据B的质量,利用元素守恒确定其成分,从而可判断比较物质稳定性的强弱。
(1)①在实验室中用NH4Cl与Ca(OH)2混合加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2 +2NH3
CaCl2 +2NH3![]() + 2H2O;
+ 2H2O;
②根据题给要求来测量氧化铜和水的质量,考虑到氨气可以和浓硫酸反应,但不和碱石灰反应,所以应该用碱石灰来吸收水,用浓硫酸来吸收氨气,由于在制取氨气的过程中会产生水,所以应该先对b装置反应产生的氨气进行干燥,即选择c装置,然后进行实验,最后为了防止氨气污染空气,所以要用浓硫酸来处理尾气,即正确的操作顺序为:b→c→a→c→d;d中浓硫酸的作用是吸收产生的多余NH3,同时防止空气中H2O进入(c)中影响结果;实验完毕时观察到(a)中的现象是固体粉末由黑色变为红色;
③设铜的相对原子质量为x,2NH3+3CuO![]() N2+3Cu+3H2O,根据方程式中物质转化关系可知:CuO与H2O的质量比为[3×(x+16)]:54,则m(CuO)产生H2O质量为m(H2O),可得比例式:
N2+3Cu+3H2O,根据方程式中物质转化关系可知:CuO与H2O的质量比为[3×(x+16)]:54,则m(CuO)产生H2O质量为m(H2O),可得比例式:![]() ,解得x=
,解得x=![]() -16;
-16;
(2)①如果氧化铜没有完全被还原为Cu单质,则会m(H2O)偏小,最终导致结算结果偏大;
②Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu,所以检验该红色物质中是否含有Cu2O,方法是:取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O;
(3)0.98 g Cu(OH)2固体的物质的量n[Cu(OH)2]=![]() =0.01 mol,根据Cu元素守恒,可知其中0.01 mol Cu(OH)2固体中含有Cu物质的量是0.01 mol,Cu的质量为m(Cu)=0.01 mol×64 g/mol=0.64 g,则固体A中含有O的质量为m(O)=0.80 g-0.64 g=0.16 g,n(O)
=0.01 mol,根据Cu元素守恒,可知其中0.01 mol Cu(OH)2固体中含有Cu物质的量是0.01 mol,Cu的质量为m(Cu)=0.01 mol×64 g/mol=0.64 g,则固体A中含有O的质量为m(O)=0.80 g-0.64 g=0.16 g,n(O)![]() =0.01 mol,n(Cu):n(O)=1:1,所以A化学式为CuO;继续加热到1000℃以上,黑色粉末全部变成红色粉末B,固体质量变为0.72 g,其中O原子的质量m(O)=0.72 g-0.64 g=0.08 g,n(O)
=0.01 mol,n(Cu):n(O)=1:1,所以A化学式为CuO;继续加热到1000℃以上,黑色粉末全部变成红色粉末B,固体质量变为0.72 g,其中O原子的质量m(O)=0.72 g-0.64 g=0.08 g,n(O)![]() =0.005 mol,n(Cu):n(O)=0.01 mol:0.005 mol=2:1,则B化学式为Cu2O,因此AB段发生的反应为:4CuO
=0.005 mol,n(Cu):n(O)=0.01 mol:0.005 mol=2:1,则B化学式为Cu2O,因此AB段发生的反应为:4CuO![]() 2Cu2O+O2
2Cu2O+O2![]() ,CuO加热至1000℃以上分解变为Cu2O,说明物质的稳定性:CuO<Cu2O。
,CuO加热至1000℃以上分解变为Cu2O,说明物质的稳定性:CuO<Cu2O。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】《木草纲日》对轻粉(Hg2Cl2)的制法作如下记载:“用水银-两,白矾(明矾)二两。食盐一两。同研不见星,铺于铁器内,以小乌盆覆之,筛灶灰盐水和,封固盆口,以炭打二炷香,取开则粉升于盆上矣。其白如雪,轻盈可爱,一两汞可升粉八钱。”下列说法正确的是( )
A.制备过程中未发生氧化还原反应
B.制备过程中发生了物质的升华
C.反应过程中一定没有氧气参与
D.该记载中,Hg2Cl2产率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,11℃时液化成红棕色液体。
(1)某研究小组用如图装置制备少量ClO2(夹持装置已略去)。
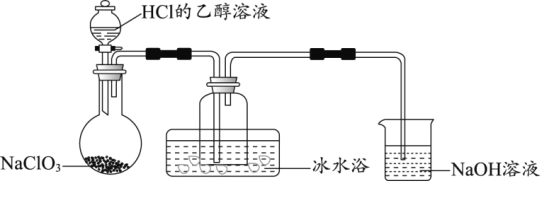
①冰水浴的作用是___。
②NaOH溶液的主要作用为吸收反应产生的Cl2,其吸收液可用于制取漂白液,该吸收反应的离子方程式为___,该反应的氧化剂与还原剂物质的量之比为___。
③以NaClO3和HCl为原料制备ClO2,完成化学方程式___。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量淀粉溶液,振荡、静置,观察到___,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生Cl-,用0.0001mol·L-1的AgNO3标准溶液滴定至终点,,测定自来水管中Cl-的含量。
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作___。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
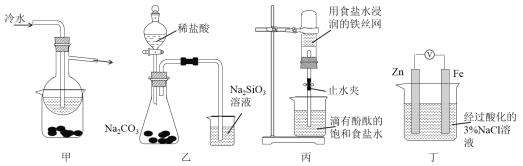
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
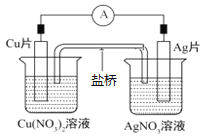
A. 正极的电极反应是Ag++e-=Ag
B. 电子沿导线由Cu片流向Ag片
C. 盐桥中的K+向Cu片移动
D. Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
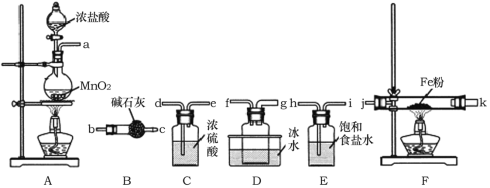
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com