

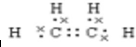 ,A分子内含有的官能团是(填名称)醛基.
,A分子内含有的官能团是(填名称)醛基.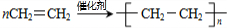 .
.分析 CH3CH2OH在Cu催化剂条件下发生催化氧化生成A为CH3CHO,CH3CHO进一步氧化生成B为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成C为CH3COOC2H5,乙醇发生消去反应生成D为CH2=CH2,乙烯发生加聚反应生成高分子物质E为聚乙烯,以此解答该题.
解答 解:CH3CH2OH在Cu催化剂条件下发生催化氧化生成A为CH3CHO,CH3CHO进一步氧化生成B为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成C为CH3COOC2H5,乙醇发生消去反应生成D为CH2=CH2,乙烯发生加聚反应生成高分子物质E为聚乙烯,
(1)由以上分析可知D为乙烯,电子式为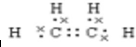 ,A为乙醛,含有的官能团为醛基,故答案为:
,A为乙醛,含有的官能团为醛基,故答案为: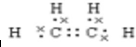 ;醛基;
;醛基;
(2)②为乙醛的氧化反应,生成乙酸,④为乙醇的消去反应,生成乙烯,故答案为:氧化反应;消去反应;
(3)①为乙醇的催化氧化反应,方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,②为乙烯的加聚反应,方程式为 ,
,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O; ;
;
(4)乙酸乙酯不溶于饱和碳酸钠溶液,可用分液的方法分离,用到的仪器有烧杯、分液漏斗等,插入试管B的导管接有一个球状物,其作用为防倒吸,
故答案为:分液漏斗;防倒吸.
点评 本题考查了有机物的推断,为高考常见题型,侧重于学生的分析能力的考查,难度不大,明确物质具有的官能团确定其具有的性质,注意官能团的变化,答题时要注意基础知识的灵活运用.


科目:高中化学 来源: 题型:实验题
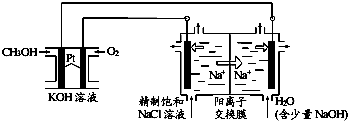
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
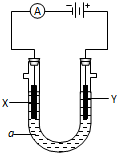 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有七行,七个周期,有18列,18个族 | |
| B. | 目前使用的元素周期表中,同一主族的元素最外层电子数相同 | |
| C. | 短周期元素是指1~20号元素,其中大多数为非金属 | |
| D. | 元素周期表中,元素的种数与对应的原子种数一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
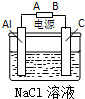 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.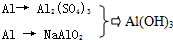
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | CH4$\stackrel{高温}{→}$C+2H2 | D. | CH≡CH+HCl$→_{△}^{催化剂}$CH2═CHCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com