
【题目】下列实验事实不能用平衡移动原理解释的是
A. 将NO2球浸泡在冷水中和热水中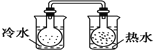
B. 
C. 
D. ![]()
【答案】C
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
A、存在平衡2NO2![]() N2O4,升高温度平衡向生成NO2方向移动,颜色变深,能用平衡移动原理解释,A不选;
N2O4,升高温度平衡向生成NO2方向移动,颜色变深,能用平衡移动原理解释,A不选;
B、水的电离是可逆过程,电离吸热,升高温度促进水的电离,Kw增大,能用平衡移动原理解释,B不选;
C、对可逆反应2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深,C选;
H2(g)+I2(g),增大平衡体系的压强,平衡不移动,故不能用勒夏特列原理解释。但体系中各气体的浓度均增大,颜色变深,C选;
D、氨水中存在一水合氨的电离平衡,浓度越稀,电离程度越大,但离子浓度降低,c(OH-)越小,pH越小,能用平衡移动原理解释,D不选。
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

己知:Zn及其化合物的性质与Al及其化合物的性质相似。下列相关说法错误的是( )
A. 用NaOH溶液处理废旧镀锌铁皮的作用是去除油污、溶解镀锌层
B. 调节溶液A的pH产生Zn(OH)2沉淀,经抽滤、洗涤、灼烧即可制得ZnO
C. 由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是防止Fe2+被氧化
D. Fe3O4胶体粒子能用减压过滤法实现固液分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。例如,
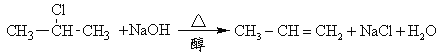
该反应式也可表示为
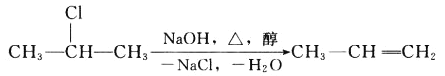
下面是几种有机化合物的转化关系:
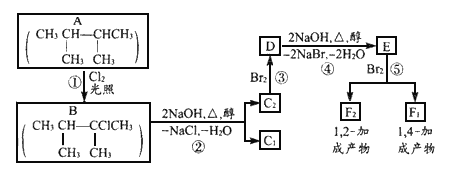
(1)根据系统命名法,化合物A的名称是_____________。
(2)写出下列反应的反应类型,①是_________③是___________。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_________。
(4)C2的结构简式是____________________________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 室温下,23g NO2气体中含有的分子数目为0.5 NA
B. 0.1mol/L醋酸溶液中含有醋酸分子的数目为0.1NA
C. 常温下,20L pH=12的Na2CO3溶液中含有OH 数目为0.2NA
D. 某密闭容器盛有0.1mol N2和0.3mol H2,一定条件下充分反应,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
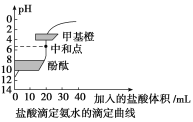
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(s)![]() cZ(g) △H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数。实验结果如图所示,下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数。实验结果如图所示,下列判断正确的是

A. △H>0
B. m<c
C. 升温,正、逆反应速率都增大,平衡常数减小
D. 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,原子序数依次递增。A元素的周期数、主族数、原子序数相同;B元素的前六级电离能的数值变化如图所示:

C元素的基态原子核外有六种不同运动状态的价电子;D与B同主族,电负性D<B;E是第四周期d区元素,血红蛋白中的E元素更易与BC形成配合物E(BC)5。
(1)写出E的基态原子电子排布式________。
(2)A3C+中,C原子采用_____杂化,离子构型为_____,比较A3C+与A2C中的键角大小并解释原因_______。
(3)D60分子中每个D原子均采用sp2杂化,则1 molD60分子中π键的数目为____。
(4)A2C有多种晶体结构,其中一种晶体中分子的空间排列方式与金刚石晶体类似,该晶体晶胞中含有____个A2C分子,A2C的配位数为_____,A2C之间的作用力为_____。已知晶胞的棱长为a pm,阿伏加德罗常数为NA,试列式计算此晶体的密度___g·cm-3(用含a、NA的代数式表示)。
(5)E(BC)5中E周围的价电子总数为____,配位原子是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 200 ℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2O2(g)===SO2(g)+H2O(g) ΔH1 ①
2H2S(g)+SO2(g)==3/2S2(g)+2H2O(g) ΔH2 ②
H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3 ③
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=2/3(ΔH1+ΔH2-3ΔH3) B. ΔH4=2/3(3ΔH3-ΔH1-ΔH2)
C. ΔH4=2/3(ΔH1+ΔH2-2ΔH3) D. ΔH4=2/3(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com