
| A. | 正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷分子储存的能量小于异丁烷分子 |
分析 设①CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1,
②(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ•mol-1,
由①-②可得CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),△H=-2878kJ•mol-1+2869kJ•mol-1=-9kJ•mol-1.
解答 解:设①CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1,
②(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)→4CO2(g)+5H2O(l)△H=-2869kJ•mol-1,
由①-②可得CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),△H=-2878kJ•mol-1+2869kJ•mol-1=-9kJ•mol-1,
A.正丁烷分子中的碳氢键和异丁烷中的碳氢键一样多,故A错误;
B.CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),△H<0,因此异丙烷比正丁烷稳定,故B错误;
C.CH3CH2CH2CH3(g)→(CH3)2CHCH3(g),△H<0,放热过程,故C正确;
D.正丁烷分子储存的能量大于异丁烷分子,故D错误;
故选C.
点评 本题考查化学能与热能的转化,为高频考点,掌握盖斯定律的应用是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
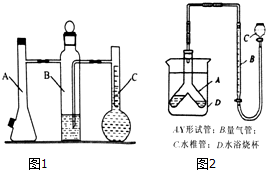
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二溴乙烷  | B. | 3-乙基-1-丁烯 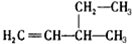 | ||
| C. | 2-甲基-2,4-己二烯 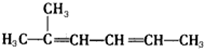 | D. | 2,4,4-三甲基戊烷 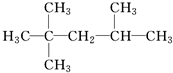 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
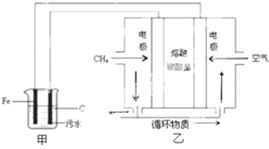
| A. | 通入空气的电极为阳极 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-=Fe3+ | |
| C. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有Fe203的悬浊液中通入HI:Fe203+6H+═2Fe3++3H20 | |
| B. | 1 mol/L NaAl02溶液和1.5 mol/L HC1溶液等体积混合:6AlO2-+9H++3H2O═5A1(OH)3+Al3+ | |
| C. | 向Ca( Cl0)2溶液中通入S02:Ca2++2ClO-+S02+H20═CaSO3+2HC1O | |
| D. | 向0.1 mol/LpH=l的NaHA溶液中加入NaOH溶液:HA-+OH-═H2O+A2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素X、Y能形成多种化合物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的弱 | |
| D. | Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com