
【题目】按要求填空。下面列出了几组物质,请将物质的合适组号填写在空格上。
A.金刚石与石墨;B.氕与氘;C.甲烷与戊烷;D.![]() 与
与 ;E.
;E.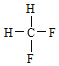 与
与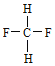 。
。
(1)同素异形体___;(2)同系物___;(3)同分异构体___。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。

(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是

A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

回答下列问题:
(1)化合物A的名称为________,化合物C中含氧官能团结构简式为____________。
(2)写出A→B的化学方程式:________________________________。
(3)D→E的反应类型为__________,F的分子式为______________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③分子中核磁共振氢谱为四组峰
(5)设计以甲苯、乙醛为起始原料(其它试剂任选),制备 的合成路线流程图:__________
的合成路线流程图:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. C3H6C12有4种同分异构体
B. 乙烯与Br2的CCl4溶液反应后,混合液分为两层
C. 乙醇被氧化一定生成乙醛
D. 合成材料会造成巨大的环境压力,应禁止使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求书写下列离子方程式:
①将过量CO2通入澄清石灰水中,反应的离子方程式为_____________________。
②Ca(HCO3)2溶液与少量Ca(OH)2溶液反应的离子方程式为___________________。
③少量Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为_____________。
④已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为__。
⑤在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为___。
还原为Cr3+,该过程的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. 当混合溶液呈中性时,![]()
D. NaHX溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com