
| A. | B、A、D、C、E | B. | C、D、B、A、E | C. | B、A、C、D、E | D. | C、D、A、B、E |
分析 同周期元素从左到右原子半径逐渐减小,对应的元素的金属性逐渐减弱,非金属性逐渐增强,根据对应化合物的碱性、稳定进行判断.
解答 解:A和B的最高价氧化物对应的水化物均呈碱性,则都为金属,且碱性B>A,同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化合逐渐减弱,则原子序数A>B,
同周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增强,C和D的气态氢化物的稳定性C>D,则原子序数C>D;E是这五种元素中原子半径最小的元素,原子序数最大.
则原子序数为:B<A<D<C<E,
故选A.
点评 本题考查元素周期律的递变规律,题目难度中等,注意元素的金属性、非金属性与对应化合物的性质.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下苯酚在水中的溶解度不大 | B. | 苯酚能跟NaOH溶液反应 | ||
| C. | 苯酚遇FeCl3溶液呈紫色 | D. | 将CO2通入苯酚钠溶液出现浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的物质的量 | B. | 升高体系的温度 | C. | 减少C的物质的量 | D. | 增加体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
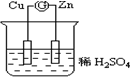 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com