
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
科目:高中化学 来源:不详 题型:单选题
 存在;
存在; 2C(g) △H=QkJ·mol-1(Q<0)
2C(g) △H=QkJ·mol-1(Q<0)
| A.①③⑥ | B.②④⑤ | C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)= SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2= O2+2NO;△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.自发反应一定是放热反应 |
| B.自发反应一定是吸热反应 |
| C.有的吸热反应也能自发进行 |
| D.吸热反应不能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
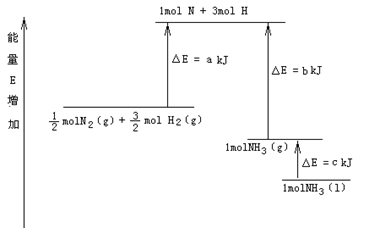
| A.1/2 mol N2和3/2 mol H2转变为原子是放出能量a KJ |
| B.1mol N 和3mol H结合成1mol NH3(g)时放出热量b KJ |
| C.1mol NH3(l)转变为1mol NH3(g)时放出热量 c KJ |
| D.1/2 mol N2和3/2 mol H2反应生成1mol NH3(l)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热反应在不加热的条件下一定不能发生 |
| B.放热反应在常温下一定很容易发生 |
| C.由“C(石墨)= C(金刚石);△H=" +119" kJ/mol ”知石墨比金刚石稳定 |
| D.化学反应中的能量变化,只表现为热能的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


 ,则乙烯燃烧的热化学方程式可表示为:
,则乙烯燃烧的热化学方程式可表示为:

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 列说法或表示方法中正确的是( )
列说法或表示方法中正确的是( )| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH="+1.9KJ/mol" ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.在稀溶液中:H+( aq )+OH-( aq)=H2O(l);ΔH="-57.3KJ/mol" ,若将0.5 mol浓H2SO4溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
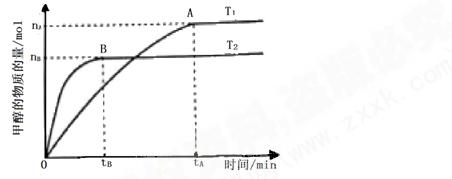
 号)
号) mol·L-1·min-1
mol·L-1·min-1 增大
增大查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com