
【题目】Fe、Cu、Mn三种元素的单质及化合物在生产、生活中有广泛应用.
![]()
![]() 是一种多功能材料,工业上常以
是一种多功能材料,工业上常以![]() 和尿素
和尿素![]() 、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的
、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的![]() 键数为 ______ .
键数为 ______ .
![]() 某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
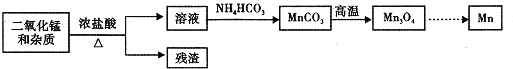
![]() 用浓盐酸溶解二氧化锰需保持通风,原因是 ______
用浓盐酸溶解二氧化锰需保持通风,原因是 ______ ![]() 用化学方程式表示
用化学方程式表示![]() .
.
![]() 写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
![]() 基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
![]() 图1是
图1是![]() 的晶胞结构,晶胞的边长为
的晶胞结构,晶胞的边长为![]() 则
则![]() 的密度为 ______
的密度为 ______ ![]() 用
用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() .
.
![]() 绿矾
绿矾![]() 是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
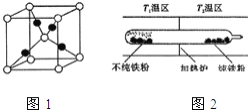
![]() 以羰基化合物为载体,提纯某纳米级活性铁粉
以羰基化合物为载体,提纯某纳米级活性铁粉![]() 含有一些不反应的杂质
含有一些不反应的杂质![]() ,反应装置如图
,反应装置如图![]() 已知:
已知:![]() ,常压下,
,常压下,![]()
![]() 的熔点约为
的熔点约为![]() ,沸点为
,沸点为![]() ,则
,则![]()
![]() 的晶体类型为 ______
的晶体类型为 ______ ![]() 请用平衡移动原理解释
请用平衡移动原理解释![]() 的原因 ______ .
的原因 ______ .
【答案】![]()
![]()
![]() 浓
浓![]()
![]()
![]() 4
4 ![]() 取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质 分子晶体 铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质 分子晶体 铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]()
【解析】
![]() 尿素分子中C原子形成3个
尿素分子中C原子形成3个![]() 键、没有孤对电子,杂化轨道数目为3,每个分子中含有7个
键、没有孤对电子,杂化轨道数目为3,每个分子中含有7个![]() 键。
键。
![]() 盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成
盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成![]() ,最后用热还原法生成Mn。
,最后用热还原法生成Mn。
![]() 氯气是有毒气体,要保持通风,避免中毒;
氯气是有毒气体,要保持通风,避免中毒;
![]() 碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳;
碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳;
![]() 铜原子核外电子数为29,根据能量最低原理书写电子排布式;与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为
铜原子核外电子数为29,根据能量最低原理书写电子排布式;与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为![]() ;
;
![]() 根据均摊法计算晶胞中白色球、黑色球数目,结合化学式判断晶胞中Cu、O原子数目,再计算晶胞质量,根据
根据均摊法计算晶胞中白色球、黑色球数目,结合化学式判断晶胞中Cu、O原子数目,再计算晶胞质量,根据![]() 计算晶胞密度;
计算晶胞密度;
![]() 绿矾变质时亚铁离子被氧化为铁离子,检验绿矾是否完全变质可以检验是否含有亚铁离子;
绿矾变质时亚铁离子被氧化为铁离子,检验绿矾是否完全变质可以检验是否含有亚铁离子;
![]() 的熔沸点低,应属于分子晶体;
的熔沸点低,应属于分子晶体;
铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 尿素分子的结构简式为
尿素分子的结构简式为![]() ,杂化轨道数目为3,所以尿素分子中碳原子的杂化方式为
,杂化轨道数目为3,所以尿素分子中碳原子的杂化方式为![]() 杂化,每个分子中含有7个
杂化,每个分子中含有7个![]() 键,所以1mol尿素中含有
键,所以1mol尿素中含有![]() 键,含有的
键,含有的![]() 键数为
键数为![]() 。答案为:
。答案为:![]() ;
;![]() ;
;
![]() 盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成
盐酸与二氧化锰在加热条件下反应产生氯气,滤液中含有二氯化锰,加入碳酸铵可生成碳酸锰,经高温生成![]() ,最后用热还原法生成Mn。
,最后用热还原法生成Mn。
![]() 浓盐酸与二氧化锰反应产生氯气,氯气是有毒气体,要保持通风,避免中毒,反应方程式为:
浓盐酸与二氧化锰反应产生氯气,氯气是有毒气体,要保持通风,避免中毒,反应方程式为:![]() 浓
浓![]() ;答案为:
;答案为:![]() 浓
浓![]() ;
;
![]() 碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳,反应的方程式为
碳酸锰在空气中灼烧时有氧气参与反应,同时生成二氧化碳,反应的方程式为![]() 。答案为:
。答案为:![]() ;
;
![]() 铜原子核外电子数为29,核外电子排布式为
铜原子核外电子数为29,核外电子排布式为![]() ,与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为
,与Cu同周期且原子序数最小的第Ⅷ族元素为Fe,其基态原子核外电子排布式为![]() ,3d能级有4个未成对电子;答案为:
,3d能级有4个未成对电子;答案为:![]() ;4;
;4;
![]() 晶胞中白色球数目为
晶胞中白色球数目为![]() ,黑色球数目为4,故白色球为O原子、黑色球为Cu原子,晶胞质量为
,黑色球数目为4,故白色球为O原子、黑色球为Cu原子,晶胞质量为![]() ,则晶胞密度为
,则晶胞密度为![]() 。答案为:
。答案为:![]() ;
;
![]() 绿矾变质时亚铁离子被氧化为铁离子,实验检验绿矾是否完全变质方法为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
绿矾变质时亚铁离子被氧化为铁离子,实验检验绿矾是否完全变质方法为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质。答案为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质。答案为:取样品溶于水,滴加酸性高锰酸钾溶液,如溶液褪色,则表示样品没有完全变质![]() 或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质;
或滴加铁氰化钾溶液,产生蓝色沉淀,则样品没有完全变质;
![]() 的熔沸点低,应属于分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
的熔沸点低,应属于分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]() ;答案为:分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区
;答案为:分子晶体;铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到高温区![]() 时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故
时,即升温平衡逆向移动,羰基合铁分解,纯铁粉残留在右端,故![]() 。
。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】反应:aX(g)+bY(g)![]() cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
cZ(g),达到平衡时测得X气体的浓度为3mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为1.4mol/L,则下列叙述不正确的是
A.a+b<cB.平衡向生成Z的方向移动
C.Z的体积分数降低D.Y的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生可逆反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
Ni(CO)4(g),已知该反应在25℃、80℃时的平衡常数分别为5×104和2,下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量的Ni(CO)4(g),达到新平衡时CO的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
①![]()
![]() 和
和![]() 的混合气体中含有的原子个数为
的混合气体中含有的原子个数为![]()
②常温下,4g ![]() 含有
含有![]() 个
个![]() 共价键
共价键
③![]() 质量分数为
质量分数为![]() 的
的![]() ,加水至100mL,
,加水至100mL,![]() 的质量分数为
的质量分数为![]()
④标准状况下,![]() 四氯化碳含有的分子数为
四氯化碳含有的分子数为![]()
⑤![]() 时,
时,![]() 的
的![]() NaClO溶液中水电离出的
NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
⑥![]() 溶液中含有
溶液中含有![]() 个
个![]()
⑦![]()
![]() 与水完全反应时转移电子数为
与水完全反应时转移电子数为![]()
A.③⑥⑦B.①②④C.①②⑤D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,lmol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断,下列说法不正确的是

A.432kJ·mol-1>E(H—Br)>298KJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
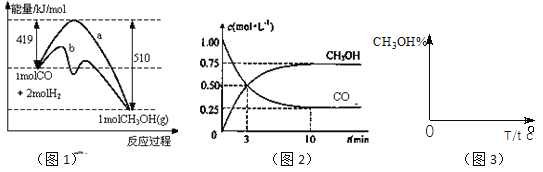
请回答下列问题:
(1)在“图1”中,曲线___(填:a或b)表示使用了催化剂;该反应属于_____(填:吸热、放热)反应。
(2)下列说法正确的是_____
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时
n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡, v(H2)=________;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线________(在曲线上标出P1、P2,且P1<P2)。
(5) 有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com