
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。

NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
回答下列问题:
根据实验目的,接口连接的顺序为
1→ → →2→3 →6→7→ → → 。
(2)C装置作用是 。
(3)B装置中发生反应的化学方程式为 ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象: 。
【答案】(1)4、5 10、9、8
(2)除去氯气中氯化氢气体
(3)3Cl2+NH4Cl==NCl3+4HCl 71~95℃
(4)NCl3+3H2O![]() 3HClO+NH3;NCl3本身无漂白性;NCl3在热水中生成NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色
3HClO+NH3;NCl3本身无漂白性;NCl3在热水中生成NH3·H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色
【解析】
试题分析:装置A为制取氯气的仪器,A制取的氯气含有氯化氢,需用装置C饱和食盐水除去氯化氢,采用长进短出的方法;然后加入装置B与氯化铵反应生成NCl3;NCl3沸点低,为防止NCl3变为气体,所以要经过冷凝管冷凝为液体,然后收集,最后进行尾气处理;(1)接口连接的顺序为1→4→5→2→3 →6→7→10→9→8。(2)C装置作用是除去氯气中氯化氢气体;(3)B装置中氯气与氯化铵反应生成NCl3,反应的化学方程式为3Cl2+NH4Cl==NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,由于NCl3沸点为71℃,且95℃爆炸,所以控制水浴加热的温度为71~95℃。(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色,说明NCl3本身无漂白性;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝说明有氨水生成,后褪色说明有漂白性的次氯酸生成,化学反应方程式NCl3+3H2O![]() 3HClO+NH3。
3HClO+NH3。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答下列问题:

(1)元素d在周期表中的位置是_____________,h与f原子序数相差______________。
(2)b、c、f的简单离子半径最小的是___________(填离子符号),原子半径最小的是______(填化学式)。
(3)表中第三周期元素的非金属性最强是_________(用元素符号表示), e、f、g三种元素的气态氢化物最不稳定的是__________(用化学式表示)。
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应为


(1)1 mol M完全燃烧需要________ mol O2。
(2)有机物N不能发生的反应为________(填字母序号)。
A.氧化反应
B.取代反应
C.消去反应
D.还原反应
E.加成反应
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色、苯环上只有两个取代基、无环物质的同分异构体有________种。
(4)物质N与H2反应生成的P(结构简式为 )发生缩聚反应产物的结构简式为________________;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为______________________________。
)发生缩聚反应产物的结构简式为________________;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为______________________________。
(5)有机物Ⅰ、Ⅱ、Ⅲ的转化关系为Ⅰ Ⅱ
Ⅱ
有机物Ⅱ的结构简式为______________;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
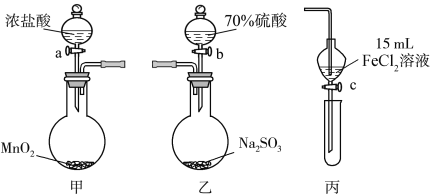
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeCl2溶液变黄时,停止加热。
3.打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2 mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为_____________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO |
Ⅱ | 有Fe3+无Fe2+ | 有SO |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的是
A. 用湿润的pH试纸测定稀盐酸的pH
B. 配制FeSO4溶液时,需加入少量铁粉和稀硫酸
C. 用碱式滴定管量取 20.00 mL 0.1 mol·L-1 KMnO4溶液
D. 用带有玻璃塞的试剂瓶储存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷,它受热易分解,为了验证其气态产物,某同学设计了如下实验装置:
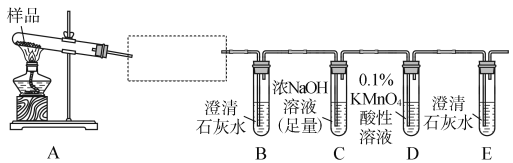
(1)若实验中,观察到B、E中的溶液均变浑浊,则D中的现象是_______________________;
说明其气态产物是________、________;为验证另一种气态产物,应在A、B之间增加的装置为________。
(2)为了使实验更安全、更严密,你认为该实验设计需要如何改进?
①______________________________;
②__________________________________。
(3)固体产物中铁元素不可能以+3价形式存在,理由是___________________________。
现设计实验,探究固体产物中铁元素的存在形式。
①提出合理假设。
假设1:_________________________________;
假设2:_________________________________;
假设3:_________________________________。
②某学生设计实验探究上述假设,除3%H2O2、蒸馏水外,还需要下列试剂中的____________________________。
限选试剂:浓硫酸、1.0 mol·L-1HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1KI溶液、0.1 mol·L-1CuSO4溶液、20%KSCN溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com