
分析 (1)氯化钡和硫酸混合,发生反应为:Ba2++SO42-=BaSO4↓,根据硫酸根和钡离子的量计算产生沉淀的质量;
(2)反应后氢离子物质的量不变,但是浓度变化,根据c=$\frac{n}{V}$计算氢离子浓度,根据pH=-lgc(H+)计pH即可.
解答 解:(1)氯化钡和硫酸混合,发生反应为:Ba2++SO42-=BaSO4↓,50mL 0.1mol/L BaCl2中钡离子的物质的量:0.05L×0.1mol/L=0.005mol,100mL 0.75mol/L H2SO4溶液中硫酸根离子的物质的量:0.1L×0.75mol/L=0.075mol,所以产生硫酸钡的物质的量0.005mol,质量是0.005mol×233g/mol=1.165g,
答:产生沉淀1.165克;
(2)100mL 0.75mol/L H2SO4溶液中氢离子的物质的量=0.75mol/L×0.1L×2=0.15mol,混合后,氢离子的物质的量不变,但是浓度变化,c=$\frac{n}{V}$=$\frac{0.15mol}{0.15L}$=1mol/L,pH═-lgc(H+)=0.
答:反应后溶液的pH为0.
点评 本题考查学生离子方程式的有关计算以及pH的计算,注意硫酸和氯化钡反应前后氢离子的物质的量不变这一点,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
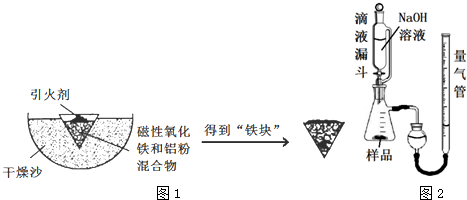
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
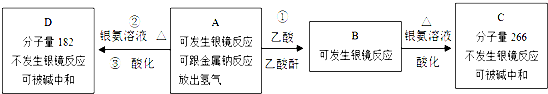
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$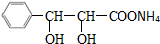 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或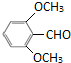 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2×102 | B. | 3.5×102 | C. | 3.2×103 | D. | 3.6×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | CuCO3 | C. | CuCO3•CuO | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

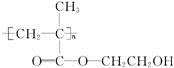 .
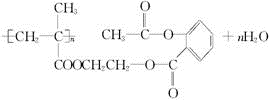
.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com