
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、S2- | B. | Fe3+、MnO4-、NO3- | C. | Cl2、HClO、Mg | D. | O2、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为不浪费,又把过量的试剂倒入试剂瓶中
B. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
某反应由两步反应构 成,反应过程中的能量变化曲线如图,下列叙述正确的是
成,反应过程中的能量变化曲线如图,下列叙述正确的是
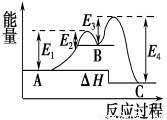
A.两步反应 均为吸热反应
均为吸热反应
B.整个反应的ΔH=E1-E2+E3-E4
C.整个反应的ΔH=E1-E2
D.三种化合物中B最稳定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
发射“嫦娥一号”月球探测卫星的长征三号甲运载火箭的第三级使用的燃料是液氢和液氧,已知下列热化学方程式:①H2(g)+1/2O2(g)==H2O(l)ΔH1=-285.8kJ/mol
②H2(g)==H2(l)ΔH2=-0.92kJ/mol,③O2(g)==O2(l)ΔH3=-6.84kJ/mol
④H2O(l)==H2O(g)ΔH4=+44.0kJ/mol则反应H2(l)+1/2O2(l)==H2O(g)的反应热ΔH为
A.+237.46kJ/mol B.-474.92kJ/mol C.-118.73kJ/mol D.-237.46kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
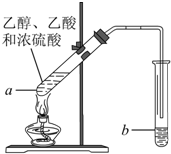 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
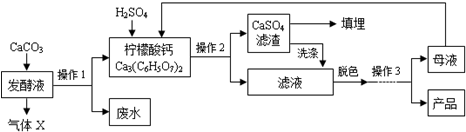
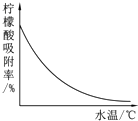 柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反应开始时,乙中反应速率比甲快 | |
| C. | 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
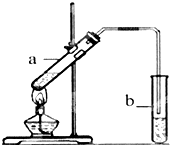 葡萄可用于酿酒.
葡萄可用于酿酒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com