
【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】美托洛尔(H)属于一线降压药,是当前治疗高血压、冠心病、心绞痛、慢性心力衰竭等心血管疾病的常用药物之一,它的一种合成路线:

已知:CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
回答下列问题:
(1)A物质是一种芳香化合物,其化学名称是_________________。
(2)反应B→C的化学方程式为___________;C→D的反应类型为.____________。
(3)D中所含官能团的名称是________________.
(4)G的分子式为________________;已知碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,则H(美托洛尔)中含有____________个手性碳原子。
(5)芳香族化合物X与C互为同分异构体。写出同时满足下列条件的X的一种结构简式__________________。
①能发生银镜反应;
②不与FeCl3发生显色反应;
③含“C-C1”键;
④核磁共振氢谱有4个峰,峰面积比为2:2:2:1.
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101 kPa时某些物质的燃烧热数据如下:
名称 | 化学式 | ΔH (kJ/mol) | 名称 | 化学式 | ΔH (kJ/mol) |
石墨 | C(s) | 393.5 | 乙烷 | C2H6(g) | 1560 |
金刚石 | C(s) | 395.0 | 乙烯 | C2H4(g) | 1411 |
氢气 | H2(g) | 285.8 | 乙炔 | C2H2(g) | 1300 |
一氧化碳 | CO(g) | 283.0 | 乙醇 | C2H5OH(l) | 1367 |
(1)相同质量的上述八种物质,完全燃烧放热最多的名称是____。
(2)石墨与金刚石互为____。
a.同位素 b.同素异形体 c.同分异构体 d.同系物
常温常压下,二者更稳定的是___。(填中文名称)
(3)在标准状况下,22.4LCO和C2H2的混合气体在过量的氧气中完全燃烧放出1096.6 kJ的热,则燃烧产生的CO2的物质的量为___mol。
(4)估算在Ni作催化剂时,乙烯与氢气发生加成反应的焓变。C2H4(g)+H2(g)=C2H6(g) ΔH=____。
(5)已知破坏下列化学键需要吸收的能量如下:
C-C | C=C | H-H |
347kJ/mol | 619kJ/mol | 436kJ/mol |
根据(4)的结论,估算C-H键的键能为____kJ/mol。
a.322.5 b.422.5 c.522.5 d.622.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:

下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]()
![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入![]() 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如图:
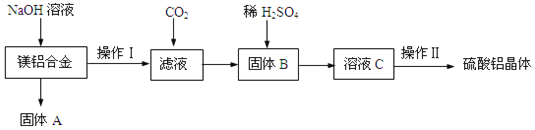
(1)在镁铝合金中加入NaOH溶液,发生反应的离子反应方程式为_____,固体B的化学式_____。
(2)操作Ⅱ包含的实验步骤有:_____、冷却结晶、过滤、洗涤、干燥。
(3)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为_____。( 在答题卷上写出计算过程)
(4)另取7.65 g该镁铝合金废料溶于400mL 3mol/L盐酸后,滴入3mol/LNaOH溶液,使所得沉淀中的Al(OH)3完全溶解,则滴入NaOH溶液的体积最少为_____mL(在答题卷上写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
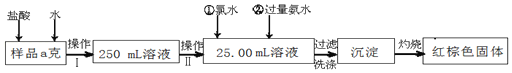
请根据上面流程,回答以下问题:
(1)操作Ⅰ是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_____、_____。(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是_____(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子反应方程式_____。
(4)检验沉淀是否已经洗涤干净的操作是_____。
(5)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“天宫一号”使用镍氢电池供电。镍氢电池的负极材料为储氢合金(用 MH表示,氢以单原子填入合金晶格),总反应为 M+Ni(OH)2![]() MH+NiOOH,下列说法正确的是( )
MH+NiOOH,下列说法正确的是( )
A. 电池充电时氢原子被氧化
B. 电池放电时正极为NiOOH
C. 电池充电时,与电源负极相连的电极反应为MH+OH-+e-=M+H2O
D. 电池放电时,负极反应为Ni(OH)2+OH--e-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容容器中进行如下反应:N2+3H2![]() 2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
A. 平衡向正反应方向移动B. 平衡向逆反应方向移动
C. NH3的百分含量增加D. 正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)
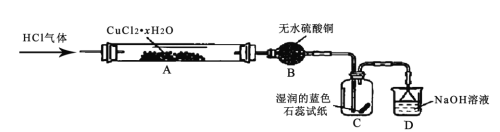
回答下列问题:
(1)装有无水硫酸铜的仪器名称为______,装置 D 的作用是______。
(2)通入 HCl 气体的主要作用是______。
(3)实验过程中,装置C 中的现象为______。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______(精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______填“偏大”“不变”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com