
| A. | 该反应中C失去电子,被还原 | |
| B. | 该反应中氢气得到电子,被还原 | |
| C. | 该反应中,每转移2mole-则生成1mol氢气. | |
| D. | 该反应属于复分解反应 |
科目:高中化学 来源: 题型:解答题
 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| B. | 纤维素→葡萄糖→CO2和H2O(释放能量维持生命活动) | |
| C. | 油脂→甘油和高级脂肪酸→CO2和H2O(释放能量维持生命活动) | |
| D. | 麦芽糖→葡萄糖→CO2和H2O(释放能量维持生命活动) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
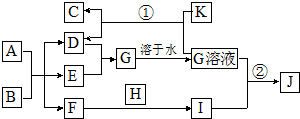 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com