
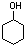
 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
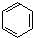 .
. ,
, ,乙炔发生加成反应生成苯,
,乙炔发生加成反应生成苯, ,加成;
,加成;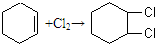 ,
,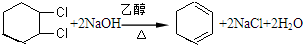 ,
,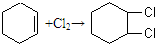 ,
, .
.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图所示,则下列判断正确的是( )| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、x>y |
| D、氧化性:MFe2Oy>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂与还原剂物质的量比为1:5 |
| C、Cl2既做氧化剂又做还原剂 |
| D、3molCl2完全反应电子转移5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 0.01mol?L-1 酸性KMnO4溶液 |
0.1mol?L-1 H2C2O4溶液 |
水 | 1mol?L-1 MnSO4溶液 |
反应温度/℃ | 反应时间 |
| I | 2ml | 2ml | 0 | 0 | 20 | 125 |
| II | 1ml | 0 | 20 | 320 | ||
| III | 0 | 50 | 30 | |||
| IV | 2ml | 2ml | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol烷烃(CnH2n+2)中含有共用电子对为0.3nNA |
| B、0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA |
| C、标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA |
| D、电解精炼铜时,电解池中每转移1mol电子时,阳极上溶解的铜原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、柠檬酸分子 |
| B、柠檬酸根 |
| C、H+ |
| D、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、所得混合液中存在c(CH3COOH)+c(CH3COO-)=0.05mol/L |
| C、混合后溶液pH=7 |
| D、混合后溶液中存c(Na+)+c(H+)=c(OH-)+c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com